一定质量的某有机物与足量的钠反应生成V1L气体。等量的该有机物与适量的纯碱(Na2CO3)反应,生成相同状况下的气体V2L。若V1>V2,那么该有机物可能是下列中的( )
| A.HO(CH2)2OH | B.HO(CH2)2COOH | C.HOOC-COOH | D.(CH3)3CCOOH |
把VL含有 和
和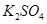 的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
A.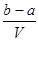 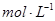 |
B.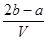 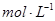 |
C.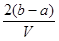 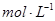 |
D.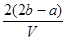 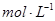 |
下列说法中错误的是 ( )
| A.从1L 1mol/L的NaCl溶液中取出10 mL,其浓度仍是1 mol/L |
| B.制成0.5L 10mol/L的盐酸,需要氯化氢气体112 L(标准状况) |
| C.0.5 L2 mol/L BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023 |
| D.10g 98%的硫酸(密度为1.84 g/cm3)与10 mL 18.4 mol/L硫酸的浓度是不同的 |
由CO2、H2和CO组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中CO2、H2和CO的体积比为()
| A.29 :8 :13 | B.22 :1 :14 | C.13 :8 :29 | D.26 :15 :57 |
若一氧化碳和二氧化碳的混合气体的密度与同温同压下氧气的密度相同,则混合气体中一氧化碳和二氧化碳的物质的量之比是()
| A.1∶3 | B.3∶1 | C.2∶1 | D.1∶2 |
在标准状况下①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3, 下列对这四种气体的关系从大到小表达正确的是 ( )
a.体积②>③>①>④ b.密度②>③>④>①
c.质量②>③>①>④ d.氢原子个数①>③>④>②
| A.abc | B.bcd | C.abcd | D.cba |