已知可逆反应AsO43-+2I-+2H+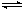 AsO33-+I2+H2O,设计如下图装置,进行下述操作:
AsO33-+I2+H2O,设计如下图装置,进行下述操作:
①向(Ⅱ)烧杯中逐滴加入浓盐酸,发现微安表(G)指针偏转;②若改往(Ⅱ)烧杯中滴加40%NaOH溶液,发现微安表指针与①的偏转方向相反。下列有关说法不正确的是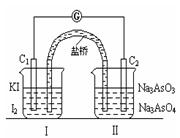
| A.①操作过程中C1棒上发生的反应为2I--2e-=I2 |
| B.②操作过程中导线上电子定向移动方向由C2→C1 |
| C.若将微安表换成电解冶炼铝装置,在②操作过程中与C2棒连接的电极上产生氧气 |
| D.若将微安表换成电解饱和食盐水装置以模拟氯碱工业,在①操作过程中与C1棒连接的可以是Pt-Fe合金电极 |
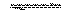
6 mol、2 mol、6 mol。在保持温度和压强不变的情况下,下列说法正确的是( )
A.将A、B、C各减少1 mol,C的百分含量减少
B.充入A、B、C各2 mol,平衡将向正反应方向移动
C.充入1 mol氦(He)(He与容器中气体不反应),平衡将向正反应方向移动
D.加入一定量的A气体达平衡后,C的百分含量一定增加
| A.将块状碳酸钙固体换成粉末状固体 | B.盐酸的量增加一倍 |
| C.盐酸的用量减半浓度加倍 | D.温度升高40 0C |

其中, (W)表示W在反应混合物中的百分含量,t表示反应时间。其它条件不变时,下列分析可能正确的是()
(W)表示W在反应混合物中的百分含量,t表示反应时间。其它条件不变时,下列分析可能正确的是()
| A.图I可能是不同压强对反应的影响,且P2>P1,a+b<n |
B.图III可能是不同温度对反应的影响,且T1>T2,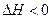 |
| C.图II可能是不同压强对反应的影响,且P1>P2,n<a+b |
| D.图II可能是在同温同压下催化剂对反应的影响,且2使用的催化剂效果好 |
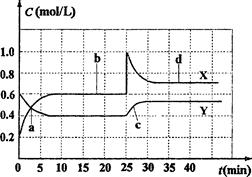
| A.图中共有两条曲线X和Y,其中曲线X表示NO2浓度随时间的变化 |
| B.a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和d |
| C.反应进行至25 min时,曲线发生变化的原因是加入0.4molN2O4 |
| D.若要达到与d相同的状态,在25 min时还能采取的措施是适当缩小容器体积 |
|
| A.烧瓶内气体的颜色不变,不再加深 |
B.NO2的物质的量浓度不变 |
| C.N2O4的消耗速率与NO2的生成速率之比为1:2 | |
| D.NO2的生成速率与NO2的消耗速率相等 |