利用工业煤制乙二醇(重要的化工原料),因具有低成本、低能耗、低排放等特点而具有非常广阔的前景,该制备过程如图所示。回答下列问题:
(1)“造气”过程的微观示意图如下,则制备合成气的化学方程式为 __,此反应属于_____________反应(填“分解”“化合”“置换”“复分解”之一)。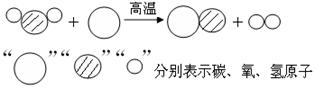
(2)合成气有还原性,可用于冶炼钢铁。请写出合成气与Fe2O3反应的一个化学方程式 。
(3)合成气在不同催化剂作用下,可以合成不同的物质。下列物质中仅用合成气为原料不可能得到的是 (填写下列各项的序号)。
①草酸(HOOCCOOH) ②尿素[CO(NH2)2]
③甲醇(CH3OH) ④醋酸(CH3COOH)
化学是一门以实验为基础的科学。根据下图所示实验,回答以下问题。
(1)A为测定空气中氧气含量的实验装置,有关反应的化学方程式为 ,通过该实验可得出氧气约占空气总体积的 的结论。
(2) 集气瓶B中的现象是铁丝在氧气中剧烈燃烧, ,放出大量的热,有黑色固体生成。该反应的化学方程式为 。
(3)1800年,英国化学家尼科尔森通过电解水得到了氢气和氧气。图C是水的电解装置,反应化学方程式为 ,实验证明了水是由 组成的化合物。
(4)用坩埚钳夹住已擦亮的镁条,放在酒精灯上点燃后,立即伸进盛有二氧化碳集气瓶中发现镁条剧烈燃烧,发出白光,放热,产生一种白色固体和一种黑色固体,该反应中生成白色固体是 ,本实验使你对燃烧条件产生的新认识是 。
右图是超市销售的一种加碘盐标签上的部分文字说明。
回答下列问题:
(1)该食盐中含有 种金属元素。每袋该食盐中碘元素的质量 mg。
(2)中国营养学会推荐:一个18岁的青年每天摄入碘元素的质量为0.15mg。假设碘的来源仅靠这种加碘食盐,该青年每天摄入这种食盐应为 g。
(1)中国的青铜举世闻名,青铜属于 材料;
(2)中国的铁锅源远流长,受到联合国卫生组织的推崇,原因之一是由于铁锅能为人体补充铁元素。若人体缺乏铁元素,容易引起 症;
(3)被发掘出的宋代铜钱已经锈迹斑斑,这是因为铜能与空气中的 、 以及二氧化碳发生化合反应生成铜绿[Cu2(OH)2CO3],请写出该反应的化学方程式: ;若要除去铜钱表面的铜绿,可选用的试剂为 (填化学式)。
(1)空气是由多种气体组成,它属于 (选填“混合物”或“纯净物”),植物的光合作用是空气中 的主要来源。
(2)合金具有良好的物理、化学性能,下列物质不属于合金的是 (选填序号)
A.黄铜 B.不锈钢 C.铁矿石
(3)锅里的油一旦着火,可用锅盖盖灭,其原理是 ;
(4)天然气的主要成分为甲烷。甲烷在空气中燃烧的化学方程式为 。化石燃料燃烧会加剧温室效应。请写出符合“低碳生活”理念的做法 。(举一例)
(5)稀土元素铕是激光及原子能应用的重要材料。已知三氯化铕的化学式为EuCl3,则氧化铕的化学式为 。
(6)户外探险缺少饮用水时,可将浑浊的河水用简易净水器进行净化,其中加入的活性炭是利用它的 性。
用化学用语填空:
(1)2个氢原子 ;(2)3个二氧化碳分子 ;
(3)保持氧气化学性质的最小粒子 ;(4)氧化亚铁中铁元素的化合价 ;
(5)硫酸根离子 ;(6)地壳中含量最多的金属元素______________。