(12分)已知元素X、Y的核电荷数小于31,且能形成XY2型的化合物。回答下列问题:
(1)若X、Y均为非金属元素,写出你所知道的XY2的化学式________________、_______________、__________________、_________________等。
(2)若X原子的外围电子层排布为3d104s2,Y可能是________元素或___________元素(写元素符号)。
填空回答:
(1)氮化硅是一种高温陶瓷材料。根据元素周期律知识,写出氮化硅的化学式:。
(2)有A、B、C、D、E、F六种元素,它们均属短周期元素,其原子序数依次增大,它们两两形成的化合物有以下几种:
| 形成的化合物 |
甲 |
乙 |
丙 |
丁 |
戊 |
| 化合物中各元素的原子个数比 |
A:C=1:1 |
B:A=1:3 |
D:C=1:1 |
E:F=1:3 |
A:F=1:1 |
已知A、B两元素的核电荷数之差等于其原子最外层电子数之和;B原子最外层电子数比次外层电子数多3个;C原子的最外层电子数是次外层电子数的3倍;D、E、F同周期,D、A同主族;E与F的原子序数之和为30,丙是离子化合物。回答:
① F元素位于周期表中的位置。
② E元素的原子结构示意图为,乙的电子式为,丙的电子式为,B的最高价氧化物的水化物的化学式为。
③向甲的水溶液中加入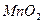 ,反应的化学方程式为。
,反应的化学方程式为。
已知某烃A含碳元素的质量分数为85.7%,可作果实催熟剂。则由A制取高分子化合物的化学方程式为。 A和水在一定条件下反应生成B。B为生活中常见的有机物,B可与另一种生活中常见有机物在一定条件下反应生成有香味的物质C,写出生成C的化学方程式。
( 12分)从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。下图表示了三种金属被人类开发利用的大致年限。
(1)上述图中的三种常用金属的开发利用之所以有先后,主要取决于
(填选项序号)
| A.金属的导电性强弱 | B.金属在地壳中的含量多少 |
| C.金属的化合价高低 | D.金属的活动性大小 |
(2)早在西汉成书的《淮南万毕术》里,就有"曾青得铁则化为铜"的记载。曾青又有空青、白青、石胆、胆矶等名称其实都是天然的硫酸铜。
①写出"曾青得铁则化为铜"的离子方程式。
②若根据上述反应设计成原电池,请在方框中画出原电池的装置图,标出正、负极和电解质溶液,并写出电极反应式。
正极反应
负极反应
③设计一个实验方案,使如图装置中的铁棒上析出铜,而铁的质量不变。(可用文字叙述也可用图示意)。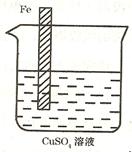
(3)铁路工人常用铝热反应来焊接钢轨,写出有关的化学方程式。
教材中引发铝热反应的试剂是。
下列各组物质:
① O2和O3 ;②1H、2H、3H;③ CH4和C10H22;④乙烷和(CH3)2CHCH2CH3;
⑤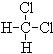 和
和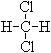 ;⑥
;⑥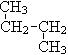 和
和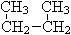
⑦ CH3 (CH2) 3 CH3和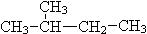
(1)互为同位素的是;(2)互为同素异形体的是;(3)互为同系物的是;(4)互为同分异构体的是;(5)属于同一物质的是。
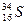 微粒中的质子数是,中子数是,核外电子数是。它与
微粒中的质子数是,中子数是,核外电子数是。它与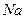 形成的化合物的电子式,此化合物类型(填“离子化合物”或“共价化合物”)。
形成的化合物的电子式,此化合物类型(填“离子化合物”或“共价化合物”)。