HClO是比H2CO3还弱的酸,当反应Cl2+H2O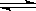 HCl+HClO达到平衡后,要使HClO的浓度增加,可加入( )
HCl+HClO达到平衡后,要使HClO的浓度增加,可加入( )
| A.NaOH固体; | B.NaCl固体; | C.H2O | D.CaCO3固体 |
下列叙述正确的是
A.检验CO2与 反应有 反应有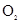 生成,可将 生成,可将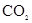 气体依次通过 气体依次通过 和浓NaOH溶液, 和浓NaOH溶液, 然后收集并用带火星的木条验证 |
B.除CO2中.混有的少量 ,可依次通过盛有酸性 ,可依次通过盛有酸性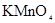 溶液、品红溶液的洗气 溶液、品红溶液的洗气瓶,得纯净CO2 |
C.检验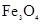 中混有 中混有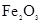 ,可将混合物加入足量稀硫酸溶液,然后取样加入 ,可将混合物加入足量稀硫酸溶液,然后取样加入KSCN溶液 |
D.检验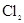 中混有 中混有 ,可将混合气体通入品红溶液 ,可将混合气体通入品红溶液 |
下列说法正确的是
A.双氧水被称为绿色氧化剂,是因为其还原产物为 ,对环境没有污染 ,对环境没有污染 |
| B.新制备的氯水中只存在三种分子、三种离子 |
C.l0mL质量分数为98%的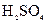 ,用水稀释至 ,用水稀释至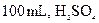 的质量分数为9.8% 的质量分数为9.8% |
| D.浓硝酸与浓盐酸一样,在空气中出现白雾 |
下列除去杂质的方法错误的是
A.除去CO中混有的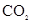 :用NaOH溶液洗气 :用NaOH溶液洗气 |
| B.除去BaSO4固体中混有的BaCO3:加过量盐酸后,过滤、洗涤 |
C.除去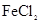 溶液中混有的 溶液中混有的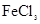 :加入过量铁粉,过滤 :加入过量铁粉,过滤 |
| D.除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤 |
实验室常利用以下反应制取少量氮气: =
=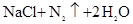 关于该反应的下列说法不正确的是
关于该反应的下列说法不正确的是
A.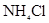 氮元素被还原 氮元素被还原 |
B.每生成 时,转移电子的物质的量为3mo1 时,转移电子的物质的量为3mo1 |
| C.被氧化的氮原子与被还原的氮原子之比为1:1 |
D. 既是氧化产物,又是还原产物 既是氧化产物,又是还原产物 |
元素的原子结构决定其性质和周期表中的位置。下列说法正确的是
| A.元素原子的最外层电予数等于元素的最高化合价 |
| B.电子层数相同的主族元素,最外层电子数多的原子半径小 |
| C.K、Mg、Al失电子能力和最高价氧化物水化物的碱性均依次增强 |
D.第三周期元素中,最外层电子数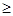 电子层数的为非金属元素 电子层数的为非金属元素 |