下列各组原子中,彼此化学性质一定相似的是()
| A.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子 |
| B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子 |
| C.2p轨道上有三个未成对的电子的X原子与3p轨道上有三个未成对的电子的Y原子 |
| D.最外层都只有一个电子的X、Y原子 |
下列叙述中正确的是()
| A.NH3、CO、CO2都是极性分子 |
| B.CH4、CCl4都是含有极性键的非极性分子 |
| C.HF、HCl、HBr、HI的稳定性依次增强 |
| D.CS2、H2O、C2H2都是直线型分子 |
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是()
| A.第一电离能:③>②>① | B.原子半径:③>②>① |
| C.电负性:③>②>① | D.最高正化合价:③>②>① |
已知A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,原子半径按D、E、B、C、A的顺序依次减小,B和E同主族,下列推断不正确的是()
A. D一定在第二周期 B. A、B、D不可能在同周期
C.A、D可能在同一主族 D.C和D的单质可能化合为离子化合物
下列关于价电子构型3s23p4的描述正确的是( )
| A.它的元素符号为O |
| B.它的核外电子排布式为1s22s22p63s23p4 |
| C.可以与H2化合生成液态化合物 |
D.其轨道表示式为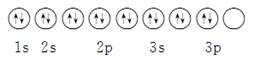 |