某同学用铝片和浓度为2 mol/L的稀硫酸10 mL反应来演示实验室制取氢气的原理,请分析下列措施对反应产生H2速率几乎无影响的是
| A.改用98%的浓硫酸 | B.改用铝粉 |
| C.改加入2 mol/L的稀硫酸100 mL | D.加热 |
反应C(s)+H2O(g) CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
| A.增加C的量 | B.将容器的体积缩小一半 |
| C.保持体积不变,升高温度 | D.压强不变充入N2使容器体积增大 |
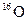 和
和 是氧元素的两种同位素,
是氧元素的两种同位素,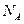 表示阿伏伽德罗常数,下列说法正确的是
表示阿伏伽德罗常数,下列说法正确的是
A.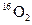 与 与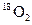 互为同分异构体 互为同分异构体 |
B.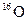 与 与 核外电子排布方式不同 核外电子排布方式不同 |
C.通过化学变化可以实现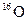 与 与 间的相互转化 间的相互转化 |
D.标准状况下,1.12L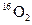 和1.12L 和1.12L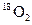 均含有0.1 均含有0.1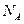 个氧原子 个氧原子 |
几种短周期元素的原子半径及主要化合价如下 表:
表:
| 元素代号[] |
X |
Y |
Z |
W |
| 原子半径/pm |
160 |
143 |
70 |
66 |
| 主要化合价 |
+2 |
+3] |
+5、+3、-3 |
-2 |
下列叙述正确的是
| A.X、Y元素的金属性 X<Y |
| B.一定条件下,Z单质与W的常见单质直接生成ZW2 |
| C.Y的最高价氧化物对应的水化物能溶于稀氨水 |
| D.一定条件下,W单质可以将Z单质从其氢化物中置换出来 |
下列排列顺序不正确的是
| A.粒子半径:Al3+ < Mg2+ < F- |
| B.热稳定性:HI > HBr > HCl > HF |
| C.酸性: H2SiO3< H3PO4< H2SO4< HClO4 |
| D.碱性: NaOH > Mg(OH)2> Al(OH)3 |
下列说法中,正确的是
| A.离子化合物中一定不含共价键,共价化合物中一定不含离子键 |
| B.水分子呈直线形,氨分子呈三角锥形 |
| C.碳原子之间可形成碳碳单键、碳碳双键或碳碳叁键 |
| D.分子间作用力越大,分子的热稳定性就越大 |