(本题共8分)高锰酸钾(KMnO4)是一种常用的氧化剂。
(1).有下列变化:CO32-→CO2、C2O42-→CO2、Fe3+→Fe2+,找出其中一个变化与“MnO4-→Mn2+”组成一个反应,写出该反应的配平的离子方程式_____________________________。
(2).不同条件下高锰酸钾可发生如下反应:
MnO4-+5e+8H+→Mn2++4H2O
MnO4-+3e+2H2O→MnO2+4OH-
MnO4-+e→MnO42-
由此可知,高锰酸根离子(MnO4-)反应后的产物与 有关。
(3).高锰酸钾可代替二氧化锰用来制取Cl2,氧化剂和还原剂物质的量之比为_____________。
(4).高锰酸钾与硫化亚铁有如下反应:
10FeS+6KMnO4+24H2SO4→3K2SO4+6MnSO4+5Fe2(SO4)3+10S+24H2O
若上述反应前后固体的质量减少了2.8g,则硫元素与KMnO4之间发生电子转移的数目为 个。
由环己烷可制得1, 4 – 环己二醇,下列有7步反应(其中无机产物都已略去)。试回答: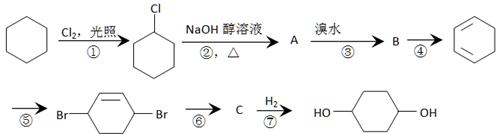
(1) 上述反应(填编号)属于取代反应。
(2) 化合物的结构简式:
B,C;
(3) 反应④所用试剂和条件是;
(4) 写出反应②、⑤的化学方程式:
反应②;
反应⑤。
下面给出了四种烃A、B、C、D的相关信息:
①烃A在所有的烃中含碳的质量分数最低;
②烃B是一种植物生长调节剂,可用于催熟果实;
③烃C在氧气中燃烧产生的氧炔焰常用来切割或焊接金属;
④烃D的分子比例模型如右图所示: 。
。
据此回答有关问题:
(1)将A和Cl2按体积比1:4混合充入一试管,密封后置于光亮处,一段时间后能看到试管内的现象是。
(2)写出把B通入溴的CCl4溶液中的化学方程式;反应类型是。
(3)实验室制取C的化学方程式为;C通入KMnO4 酸性溶液中观察到的现象是,C发生了反应。
(4) D分子中不存在一般的碳碳单键和碳碳双键交替结构,以下能证实这一事实的是。
a.D的邻位二氯取代物不存在同分异构体
b.D的间位二氯取代物不存在同分异构体
c.D的对位二氯取代物不存在同分异构体
下图是维生素A的分子结构:
(1)维生素A中的含氧官能团是(写名称);
(2)维生素A的分子式是 ;
(3)1mol维生素A最多能与mol溴反应;
(4)试指出维生素A可能发生的化学反应类型(任写一种即可)。
按要求完成下列问题。
(1)甲基的电子式
(2)通式为CnH2n+2的最简单同系物的分子式
(3)相对分子质量为72且沸点最低的烷烃的结构简式 _____________________
(4)1,3-丁二烯的键线式
现有100mL AlCl3与MgSO4的混合溶液,分成两等份。
(1)向其中一份中加入10mL 4mol/L的氨水,恰好完全反应,其中AlCl3与氨水反应的离子方程式是。继续加入l mol/L NaOH溶液至10mL时,沉淀不再减少,沉淀减少的离子方程式是,剩余的沉淀的物质的量是。
(2)向另一份中加入a mL 0.1mol/LBaCl2溶液能使SO42-沉淀完全,a=。