(本题共8分)将2molCO2和6molH2充入容积为3L的密闭容器中,在一定温度和压强条件下发生了下列反应:CO2(g)+3H2 (g) CH3OH(g)+H2O(g) +49.0 kJ。反应在2分钟时达到了平衡。
CH3OH(g)+H2O(g) +49.0 kJ。反应在2分钟时达到了平衡。
(1).用H2与CO2浓度的变化表示该反应的速率,以它们的速率表示反应达到平衡的关系式是_____________________。
(2).当改变反应的某一个条件,平衡一定向正反应方向移动的是__________。
a.逆反应速率先增大后减少 b.正反应速率先增大后减少
c.某反应物的体积百分含量减小 d.化学平衡常数K值增大
(3).达到平衡时,改变温度(T)和压强(P),反应混合物中CH3OH的“物质的量分数”变化情况如图所示,关于温度(T)和压强(P)的关系判断正确的是 (填序号)。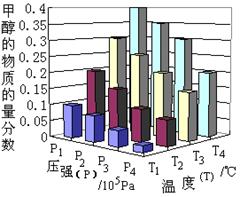
| A.P3>P2T3>T2 | B.P2>P4T4>T2 |
| C.P1>P3T1>T3 | D.P1>P4T2>T3 |
(4).平衡时,测得H2O(g)的物质的量分数为0.30,则用H2O(g)的物质的量浓度变化来表示该反应在2分钟内的平均反应速率为 mol ∙ L-1∙ min-1。
根据下面的反应路线及所给信息填空。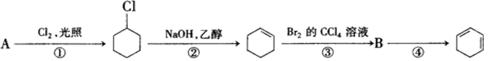
(1)A的结构简式是__________,名称是__________。
(2)①的反应类型是__________;②的反应类型是__________。
(3)反应④的化学方程式是_______________________________________。
(共10分)将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。已知,通入CH4的一极,其电极反应式是:CH4-8e-+10OH-==CO32-+7H2O;通入O2的另一极,其电极反应式是:2O2+8e-+4H2O==8OH-。请完成下列各空:
(1)通入CH4的电极为极,发生反应。
(2)该燃料电池的总反应式为。
(3)若将该电池中的燃料改为氢气,请写出此时正负极的反应式:
正极:,负极。
(共12分)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2 (g)+3 H2(g) 2NH3(g)
2NH3(g)
(1)若反应某时刻t时,n t (N2) ="=" 13 mol,n t (NH3)="=" 6 mol,则a ==__________mol;
(2)反应达平衡时,混合气体的体积为716.8 L(标况下),其中NH3的含量(体积分数)为25%,平衡时NH3的物质的量__________;
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比、下同),n(始)∶n(平) =__________;
(4)原混合气体中,a∶b =__________;
(5)达到平衡时,N2和H2的转化率之比,α(N2)∶α(H2)="=" __________;
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3) ==__________________。
(共9分)现有A、B、C、D、E、F六种短周期元素,原子序数依次增大。已知A与D、C与E分别同主族,D、E、F同周期;A、B的最外层电子数之和与C的最外层电子数相等,A与C形成的化合物常温下均为液态,A分别与E、F形成的气体分子电子总数相等。请回答下列问题:
(1)元素B在周期表中的位置。
(2) A2C比A2E沸点高的原因是____________________________。
(3)写出同时含A、B、C、E四种元素的三种盐的化学式 、、 。
(4)A2C的电子式为,C和D形成的一种化合物与A2C发生氧化还原反应,该反应的离子方程式为 。
(5)B元素的最高价氧化物的水化物与其氢化物反应的离子方程式 。
(6)在一定条件下,A、C的单质和A、C、D形成的离子化合物的水溶液可构成电池,该电池在放电过程中,电解质溶液的pH将________(填“增大”、“减小”或“不变”)。
(共4分)(1)写出下列物质的电子式: HClO。
(2)用电子式表示下列物质的形成过程:CaCl2。