氮化钠和氢化钠与水反应的化学方程式如下:Na3N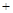 3H2O → 3NaOH + NH3↑,
3H2O → 3NaOH + NH3↑,
NaH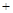 H2O → NaOH
H2O → NaOH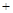 H2↑。有关Na3N和NaH的叙述正确的是( )
H2↑。有关Na3N和NaH的叙述正确的是( )
A.离子半径:Na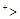 N N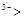 H H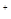 |
B.加热熔化时,都只破坏离子键 |
| C.与盐酸反应都只生成一种盐 | D.与水反应都是氧化还原反应 |
已知①2C(s)+O2(g) 2CO(g) ΔH="-221.0" kJ·mol-1
2CO(g) ΔH="-221.0" kJ·mol-1
②2H2(g)+O2(g) 2H2O(g) ΔH="-483.6" kJ·mol-1
2H2O(g) ΔH="-483.6" kJ·mol-1
则反应C(s)+H2O(g) CO(g)+H2(g)的ΔH为( )
CO(g)+H2(g)的ΔH为( )
| A.+131.3 kJ·mol-1 | B.-131.3 kJ·mol-1 | C.-352.3 kJ·mol-1 | D.+262.6 kJ·mol-1 |
甲醛是一种重要的化工产品,可以利用甲醇脱氢制备,反应式如下:
①CH3OH(g) CH2O(g)+H2(g) ΔH1="+84.2" kJ·mol-1
CH2O(g)+H2(g) ΔH1="+84.2" kJ·mol-1
向反应体系中通入氧气,通过反应②2H2(g)+O2(g) 2H2O(g) ΔH2="-483.6" kJ·mol-1提供反应①所需热量,要使反应温度维持在700 ℃,则进料中甲醇与氧气的物质的量之比约为( )
2H2O(g) ΔH2="-483.6" kJ·mol-1提供反应①所需热量,要使反应温度维持在700 ℃,则进料中甲醇与氧气的物质的量之比约为( )
| A.5.74∶1 | B.11.48∶1 | C.1∶1 | D.2∶1 |
下列热化学方程式中,正确的是( )
A.甲烷的燃烧热ΔH为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g) CO2(g)+2H2O(g) ΔH="-890.3" kJ·mol-1 CO2(g)+2H2O(g) ΔH="-890.3" kJ·mol-1 |
B.含20.0 g的NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ 的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq) CH3COONa(aq)+H2O(l) ΔH="-57.4" kJ·mol-1 CH3COONa(aq)+H2O(l) ΔH="-57.4" kJ·mol-1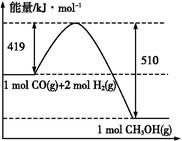 |
C.上图是298 K、101 Pa时CO和H2合成CH3OH(g)的反应过程中能量变化的曲线图,则该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g) ΔH="+91" kJ·mol-1 CH3OH(g) ΔH="+91" kJ·mol-1 |
D.已知:2Zn(s)+O2(g) 2ZnO(s) ΔH="-701.0" kJ/mol 2ZnO(s) ΔH="-701.0" kJ/mol |
2Hg(l)+O2(g) 2HgO(s) ΔH="-181.6" kJ/mol
2HgO(s) ΔH="-181.6" kJ/mol
则Zn(s)+HgO(s) ZnO(s)+Hg(l) ΔH="-259.7" kJ·mol-1
ZnO(s)+Hg(l) ΔH="-259.7" kJ·mol-1
已知甲烷燃烧生成二氧化碳和液态水放出的热量为55.625 kJ·g-1。下列热化学方程式中不正确的是( )
A.CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH ="-890" kJ/mol CO2(g)+2H2O(l) ΔH ="-890" kJ/mol |
B.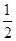 CH4(g)+O2(g) CH4(g)+O2(g) 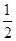 CO2(g)+H2O(l) ΔH="-445" kJ/mol CO2(g)+H2O(l) ΔH="-445" kJ/mol |
C.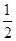 CO2(g)+H2O(l) CO2(g)+H2O(l) 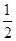 CH4(g)+O2(g) ΔH="+445" kJ/mol CH4(g)+O2(g) ΔH="+445" kJ/mol |
D.CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH="-55.625" kJ/mol CO2(g)+2H2O(l) ΔH="-55.625" kJ/mol |
热化学方程式C(s)+H2O(g) CO(g)+H2(g) ΔH="+131.3" kJ·mol-1表示的
CO(g)+H2(g) ΔH="+131.3" kJ·mol-1表示的
为( )
| A.碳与水反应吸收131.3 kJ的热量 |
| B.1 mol碳和1 mol水反应吸收131.3 kJ的热量 |
| C.1 mol固态碳与1 mol水蒸气反应产生一氧化碳气体和氢气,吸收131.3 kJ的热量 |
| D.固态碳和气态水各1 mol反应,放出131.3 kJ的热量 |