某无色溶液中可能含有Na+、K+、Fe3+、NH4+、Cu2+、SO42-、SO32-、CO32-、Cl-、Br- 这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:
①用pH试纸检验,溶液的pH>7
②取少量原溶液,加入过量的BaCl2和盐酸的混合溶液,无白色沉淀产生
③另取少量原溶液,加入足量的氯水,无气体产生,再加入CCl4振荡,静置后CCl4层呈橙色,用分液漏斗分离
④向分液后的水溶液中加入Ba(NO3)2溶液和HNO3溶液,有白色沉淀产生,过滤。
⑤在滤液中加入的AgNO3和HNO3的混合溶液有白色沉淀产生
则关于原溶液的判断中不正确的是( )
| A.肯定不存在的离子是Fe3+、NH4+、Cu2+、SO42-、CO32- |
| B.肯定存在的离子是Na+、K+、SO32-、Br- |
| C.无法确定原溶液中是否存在Cl- |
| D.若步骤④改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响 |
下列有关说法正确的是
| A.Hg(l) + H2SO4(aq) = HgSO4(aq) + H2(g)常温下不能自发进行,说明△H<0 |
| B.用惰性电极电解1L1mol/L的CuSO4溶液,当阴极析出3.2 g铜时,加入0.05 molCu(OH)2固体可将溶液恢复至原浓度 |
| C.已知25℃时,Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=2.0×10-12,所以AgCl的溶解度大于Ag2CrO4的溶解度 |
| D.25℃时,向0.1 mol/L CH3COOH溶液中加入少量CH3COONa固体,该溶液中水的电离程度将增大,且Kw不变 |
已知反应:2SO2(g)+ O2(g)  2SO3(g).某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
2SO3(g).某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
| A.由图甲推断,B点SO2的平衡浓度为0.3mol·L-1 |
| B.由图甲推断,A点对应温度下的平衡常数为80 |
| C.达平衡后,缩小容器容积,则反应速率变化图像可以用图乙表示 |
| D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则△H<0 |
25℃时,弱酸的电离平衡常数如下表,下列表述错误的是
| 弱酸 |
CH3COOH |
HCN |
H2CO3 |
| K |
1.8×10-5 |
4.9×10-10 |
K1=4.3×10-7 K2=5.6×10-11 |
A.CN-+H2O+CO2→HCN+HCO3-
B.相同温度时三种浓度相同溶液,pH关系:Na2CO3> NaCN > CH3COONa
C.等体积、等物质的量浓度的CH3COOH和Na2CO3混合反应后:
c(Na+)>c(HCO3-)>c(CH3COO-)>c(OH-)>c(H+)
D.amol/L HCN与bmol/L NaOH等体积混合溶液c(Na+)>c(CN-),则a一定小于b
下表中根据实验操作和现象所得出的结论正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
蘸有浓氨水的玻璃棒靠近溶液X |
有白烟产生 |
X一定是浓盐酸 |
| B |
某钠盐W中加入稀硫酸,产生的无色无味的气体通入澄清石灰水 |
石灰水变浑浊 |
W一定是Na2CO3 |
| C |
强酸性溶液Y中加入Ba(NO3)2溶液,静置后再加入KSCN溶液 |
先有白色沉淀, 后溶液又变红 |
Y中一定含有SO42-和Fe3+ |
| D |
少量气态炔烃Z通入pH=a的溴水中 |
溴水褪色,溶液的pH仍约为a |
Z与溴发生了加成反应 |
菠萝酯常用作化妆品香料,其合成方法如下: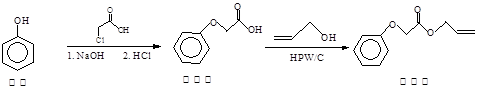
下列说法正确的是
| A.菠萝酯可以使溴水、高锰酸钾溶液褪色 |
| B.1mol菠萝酯最多可以消耗2mol氢氧化钠 |
| C.中间体中所有的原子都可以共平面 |
| D.中间体和菠萝酯中均不含手性碳原子 |