下面列出了几组物质,请将物质的合适组号填写在空格上。
同位素 ,同素异形体 ,同分异构体 ,同系物 。
①金刚石与“足球烯”C60; ②氧气(O2)与臭氧(O3) ; ③16O、17O和18O;
④ D与T ; ⑤乙醇(CH3CH2OH)和甲醚(CH3OCH3);
⑥CH4和CH3CH2CH3;
⑦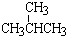 和
和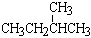 ; ⑧
; ⑧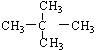 和
和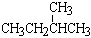 ;
;
⑨
有三种物质AC2(气体)、B2C2、AD4,元素A的最高正价和负价绝对值相等;元素B的单质能在C的气态单质中剧烈燃烧,火焰呈黄色,并生成淡黄色固体B2C2;元素D的负一价阴离子电子层结构与氩原子相同,则:
(1)A、B、C、D的元素名称分别为、、、。
(2)AD4分子其中含有的σ键类型为(选填“s-sσ键”、“s-p σ键”或“p-pσ键”)。
(3)D的负一价阴离子的电子排布式为,B2C2的电子式为,属(填“离子化合物”或“共价化合物”)。
等电子体是指原子数相同,也相同的微粒。例如: CO和
(1)和是衡量共价键稳定性的参数。
(2)键长是形成共价键的两个原子之间的间距。键长越长,键能(填“大”或“小”),键越断裂,化学性质越(填“稳定”或“不稳定”)。
(3)键角是描述的重要参数,分子的许多性质都与键角有关。CO2是形分子,键角。H2O是型分子,键角。
(1)原子轨道中相互重叠形成的和总称价键轨道,是分子结构的价键理论中最基本的部分。
(2)σ键强度π键(填“>”“〈”或“=”)
(3)σ键的特征是:以形成的两原子核的连线为轴作旋转操作,共价键的电子云。
按共价键的共用电子对理论,不可能有H3、H2Cl、和Cl3分子,这表明共价键具有。