目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下: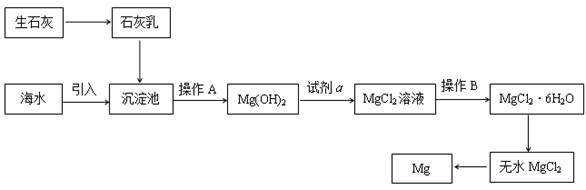
请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是 ,写出在沉淀池的离子方程式 。
(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度,生产生石灰的主要原料来源于海洋中的 。
(3)操作A是 , 操作B是 。
(4)加入的足量试剂a是 (填化学式)。
(5)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为
。从考虑成本和废物循环利用的角度,副产物氯气可以用于 。
(6)海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?
。
(7)有同学认为:可直接加热Mg(OH)2得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你 (填“同意”或“不同意”)该同学的想法,理由是 。
有如下有机物:
①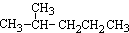 ②
②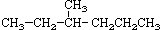 ③
③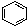
④CH3CH=CHCH3 ⑤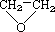 ⑥
⑥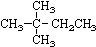 ⑦
⑦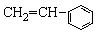
(1)互为同分异构体的是:__________,存在手性异构体的是:____________,存在顺反异构体的是__________,互为同系物的是(任写一对):__________;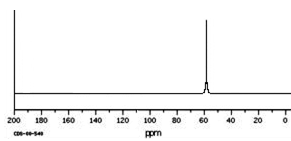
(2)氢核磁共振(1H-NMR)图谱如上图所示的有_______________________;
(3)上述物质中,不属于同分异构体,相同质量时,在氧气中完全燃烧消耗的氧气的质量完全相同的烃是:____________________;
(4)有机物④的系统命名法名称是_____________________;
(5)有机物⑤的键线式_____________,其分子中碳原子_______杂化。
恒温、容积为1 L恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示[已知:2SO2(g) + O2(g)  2SO3(g) △H = - 196.6 kJ/mol ]。
2SO3(g) △H = - 196.6 kJ/mol ]。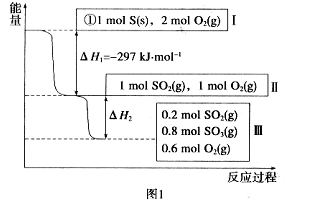
请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式:____________________。
(2)△H2 =" ____________" kJ/mol。
(3)在相同条件下,充入1 mol SO3和0.5 mol O2,则达到平衡时SO3的转化率为_________;此时该反应_______(填“放出”或“吸收”)________ kJ的能量。
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g)  CO2(g)+H2(g)反应过程中测定的部分数据见下表
CO2(g)+H2(g)反应过程中测定的部分数据见下表
| 反应时间/min |
n(CO)/mol |
n(H2O)/ mol |
| 0 |
1.20 |
0.60 |
| t1 |
0.80 |
|
| t2 |
0.20 |
依据题意回答下列问题:
(1)反应在t1min内的平均速率为v(H2)= mol·L-1·min-1
(2)若保持其他条件不变,起始时向容器中充入0.60molCO(g)和0.30 molH2O(g),到达平衡时,n(CO2)= mol。
(3)若保持其他条件不变,向平衡体系中再通入H2O(g) 、CO2(g)各0.10mol,达到新平衡时CO2(g)的体积分数为 。
(4)若温度升至800℃,上述反应平衡常数为0.64,则正反应为 反应(填“放热”或“吸热” )。
回答下列问题
(1)向一体积不变的密闭容器中加入2molNO2气体,发生反应2NO2(g)  N2O4(g),反应达平衡后,N2O4的体积分数为a,在温度不变的条件下,再向该容器加入1molN2O4气体,反应重新达平衡后,N2O4的体积分数为b,则a_____________b(填“>”“=”“<”,)
N2O4(g),反应达平衡后,N2O4的体积分数为a,在温度不变的条件下,再向该容器加入1molN2O4气体,反应重新达平衡后,N2O4的体积分数为b,则a_____________b(填“>”“=”“<”,)
(2)已知胆矾溶于水时溶液温度降低.胆矾分解的热化学方程式为________________
CuSO4•5H2O(s) CuSO4(s)+5H2O(l)△H=+Q1 mol•L﹣1.室温下,若将1mol无水硫酸铜溶解为溶液时放热Q2 kJ,则Q1 Q2(填写>,=或<)
CuSO4(s)+5H2O(l)△H=+Q1 mol•L﹣1.室温下,若将1mol无水硫酸铜溶解为溶液时放热Q2 kJ,则Q1 Q2(填写>,=或<)
(1)写出醋酸的电离方程式:__________________________。
(2) 下列方法中,可以使0.10 mol·L-1 CH3COOH溶液中CH3COOH电离程度增大的是 。
a.加入少量0.10 mol·L-1的稀盐酸
b.加入少量冰醋酸
c.加入少量氯化钠固体
d.加热CH3COOH溶液
e.加入Zn粒
f.加入少量0.10 mol·L-1的CH3COONa溶液
(3)若25℃时,在0.5 L 0.2 mol·L-1的CH3COOH溶液中,有0.01 mol的CH3COOH电离成离子。该温度下CH3COOH的电离常数K=_____________。