在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 |
X |
Y |
Z |
| 初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
| 平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.1 |

 下列说法错误的是:
下列说法错误的是:

 A.反应达到平衡时,X的转化率为50%
A.反应达到平衡时,X的转化率为50% B.反应可表示为X+3Y
B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600 C.增大压强使平衡向生成Z的方向移动,平衡常数增大
C.增大压强使平衡向生成Z的方向移动,平衡常数增大 D.改变温度可以改变此反应的平衡常数
D.改变温度可以改变此反应的平衡常数
利用下图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是()
| A.氯碱工业中,若X、Y均为石墨,Y附近能得到氯气 |
| B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 |
| C.外加电流的阴极保护法中,Y是待保护金属 |
| D.电镀工业中,X是待镀金属,Y是镀层金属 |
仅用一种试剂鉴别如下物质:苯、CCl4、NaI溶液、NaCl溶液、Na2SO3溶液,下列试剂中不能选用的是()
| A.溴水 | B.FeCl3溶液 | C.酸性KMnO4溶液 | D.AgNO3溶液 |
已知:在101 kPa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热,单位为kJ/mol。下列有关热化学方程式的叙述正确的是()
| A.已知2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ·mol-1,则氢气的燃烧热为285.8 kJ·mol-1 |
| B.已知C(石墨,s)=C(金刚石,s) △H>0,则金刚石比石墨稳定 |
| C.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为: NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.4 kJ/mol |
| D.己知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g) △H2,则△H1>△H2 |
下列关于有机物的叙述正确的是()
| A.石油、天然气和煤的主要成分都是烷烃 |
| B.乙烯和苯都能使溴水褪色,故不能用溴水鉴别乙烯和苯蒸气 |
| C.乙醇、乙酸和乙酸乙酯都能发生取代反应和氧化反应 |
| D.棉花与合成纤维的主要成分均为纤维素 |
常温下,下列溶液中可能大量共存的离子组是()
A.加入金属镁能产生H2的溶液中: Na+、Fe3+、SO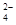 、NO 、NO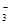 |
B.含有大量Fe2+的溶液中: K+、Mg2+、ClO-、SO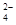 |
C.能使Al3+生成沉淀的溶液中: NH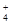 、Na+、SiO 、Na+、SiO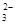 、HCO 、HCO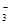 |
D.水电离产生的c(OH-)=1×10-10mol/L的溶液中: Al3+、SO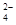 、NO 、NO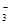 、Cl- 、Cl- |