(12分)海带中含有丰富的碘。为了从海中提取碘,某研究性学习小组设计并进行了以下实验:
请填写下列空白:
⑴步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是 (从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
| A.烧杯 | B.坩埚 | C.表面皿 | D.泥三角 E、酒精灯 F、干燥器 |
⑵步骤③的实验操作名称是 ;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。
⑶步骤④反应的离子方程式是 。
⑷步骤⑤中,某学生选择用苯来提取碘的理由是 。
⑸请设计一种检验提取碘后的水溶液中是否还有单质碘的简单方法: 。
(12分)如图为实验室制取和收集纯净干燥的氯气,并进行氯气性质探究的实验装置图:
|
下列是与硫元素相关的一系列实验:根据下图所示实验回答下列问题:
(1)试管C口部的棉团上(碱过量)发生反应的离子方程式是
(2)反应一段时间后,停止反应,将B试管中的溶液加热,可以观察到。试管C中溶液变浑浊,则证明SO2具有性。
(3)试管C口部的棉团既可浸碱溶液,又可浸NaHCO3溶液,其作用是,如果浸NaHCO3溶液(过量),则发生反应的化学方程式是。
(4)如将B试管换成D试管,并从直立导管中向BaCl2溶液中通入另一种气体,产生白色沉淀,则气体可以是(写两种)
下图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时必须使用铁屑、6 mol/L硫酸溶液,其他试剂任选。填写下列空白: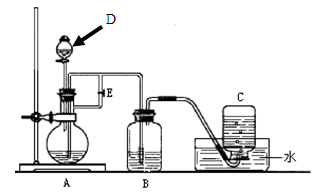
(1)B中盛有一定量的NaOH溶液,D仪器的名称,A中反应的离子方程式为。
(2)实验开始时应先将活塞E(填“打开”或“关闭”), 在C中收到的气体主要为;当C瓶或A瓶中的气泡时,将活塞E(填“打开”或“关闭”),此刻B瓶中可能发生的化学反应(用离子方程式表示,有几个写几个)是:;
(3)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:。
如图是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置。
(1)要将C装置接入B和D之间,正确的接法是:a→_____→______→d。
(2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C装置后进入D,D装置内盛有炭粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为___________________________。为了使C装置发挥更好的作用,可向烧杯中加入浓硫酸,加入浓硫酸的作用是_________。
(3)D处反应完毕后,关闭旋塞K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是_________________________________
(4)用量筒量取20 mL E中溶液,倒入已检查完气密性良好的分液漏斗中,然后再注入10 mL CCl4,盖好玻璃塞(如图),振荡,静置于铁架台上,等分层后取上层液和下层液,呈黄绿色的是_____(填“上层液”或“下层液”),再装入如图所示的烧杯中,能使有色布条褪色的是____(填“上层液”或“下层液”)。
(5)在A、B、C、D、E装置中有一处需要改进,在方框中画出改进后的装置图
实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4NH4++6HCHO=3H++6H2O+(CH2)6N4H+(滴定时,1 mol(CH2)6N4H+与 l mol H+相当),然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
步骤I:称取样品1.500g。
步骤II:将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察。
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④判断滴定终点的现象是。
⑤如图是某次滴定时的滴定管中的液面,其读数为mL。
(2)滴定结果如下表所示:
若NaOH标准溶液的浓度为0.1050mol·L-1则该样品中氮的质量分数为。