(14分)化学反应速率和限度是中学化学原理中很重要部分,根据所学知识回答下列问题:
I、用纯净的锌粒与稀盐酸反应制取氢气气体,请回答: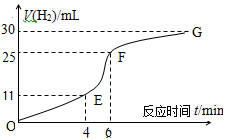
(1)实验过程如图所示,分析判断 段化学反应速率最快。
(2)将锌粒投入盛有稀盐酸的烧杯中,刚开始时产生H2的速率逐渐加快,其影响因素是 ,一定时间后反应速率逐渐减慢,其原因是 。
(3)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是( )
| A.蒸馏水 | B.氯化钠固体 | C.氯化钠溶液 | D.浓盐酸 E.降低温度 |
II、某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。由图中数据分析: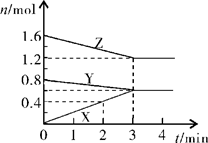
(1)该反应的化学方程式: ;
(2)反应开始至2min末,X的反应速率为 (mol·L-1·min-1);
(3)3min后图中曲线所表示的含义是 。
下列几组物质:
| A.金属石和石墨 | B.C2H6和C5H12 | C.C2H4和C2H6 |
| D.CH3CH2CH2CH3 E.35Cl和37Cl |
(1)属于同分异构体的是___________(填序号,下同);(2)属于同素异形体的是____________;
(3)属于同素物的是___________;(4)属于同位素的是________________。
在NaCl、NH4Cl、N2、CO2中,只含有离子键的是________(填化学式,下同),只含有极性键的是_________,只含有非极性键的是__________,既含有离子键又含有共价键的是__________。
在①6Li ②14N ③7Li ④14C几种核素中:
(1)________和________(填序号,下同)互为同位素。
(2)________和________的质量数相等,但不能互称同位素。
已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平,A对氢气的相对密度为14;②2CH3CHO+O2 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线 如下图所示。
如下图所示。
回答下列问题:
(1)A的相对分子质量为: ;结构简式为: 。
(2)B、D分子中的官能团名称分别是 、 。
(3)写出下列反应的反应类型:
① ,④ 。
(4)写出下列反应的化学方程式:
① ;
④ 。[来
下表为元素周期表的一部分,请回答有关问题:
| IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
|
| 2 |
① |
② |
|||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
(1)④和⑦的元素符号是和;
(2)表中8种元素中,金属性最强的元素的元素符号是,非金属性最强的元素的元素符号是。
(3)表中能形成两性氢氧化物的元素名称是,写出该元素的氢氧化物与③的最高价氧化物对应水化物反应的离子反应方程式:。