.(10分)80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4(g) 2NO2(g) △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2(g) △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) n(mol) |
0 |
20 |
40 |
60 |
80 |
100 |
| n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
| n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
①计算20s—40s内用N2O4表示的平均反应速率为 ;
②计算在80℃时该反应的平衡常数K= ;
③反应进行至100s后将反应混合物的温度降低,混合气体的颜色(填“变浅”、“变深”或“不变”) ;
④要增大该反应的K值,可采取的措施有(填序号) 。
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
⑤在同条件下,如果将0.40mol的N2O4气体充入2L已经抽空的固定容积的绝热密闭容器中,最终达到平衡后n(NO2) 0.60 mol(填“> ”、“<”或“=”)。
第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。
请回答以下问题:
⑴认真分析上图中同周期元素第一电离能的变化规律,将Na——Ar之间六种元素用短线连接起来,构成完整的图像。
⑵从上图分析可知,同一主族元素原子的第一电离能I1变化规律是____________;
⑶上图中5号元素在周期表中的位置是__________________________;
⑷上图中4、5、6三种元素的气态氢化物的沸点均比同主族上一周期的元素气态氢化物低很多,原因是:_________________________________________________。
(5)同周期内,随原子序数增大,I1值增大。但个别元素的I1值出现反常现试预测下列关系式中正确的是__________。
①E(砷)>E(硒)②E(砷)<E(硒)③E(溴)>E(硒)④E(溴)<E(硒)
(6)用氢键表示式写出HF溶液中存在的所有氢键_________________________________
联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能放出大量的热。
(1)已知:2NO2(g)===N2O4(g)△H=-57.20kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g) N2O4(g)达到平衡。其他条件不变时,下列措施能提高NO2转化率的是 (填字母)。
N2O4(g)达到平衡。其他条件不变时,下列措施能提高NO2转化率的是 (填字母)。
| A.减小NO2的浓度 | B.降低温度 |
| C.增加NO2的浓度 | D.升高温度 |
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)的△H=kJ·mol-1。
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)="0.0300" mol·L-1、c(N2O4)="0.0120" mol·L-1。则此温度下平衡常数K=____________
如下图所示的装置,C、D、E、F都是惰性电极。将电源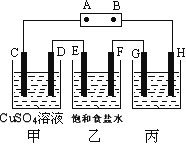 接通后,向乙中滴入酚酞液,在F极附近显红色。试回答:
接通后,向乙中滴入酚酞液,在F极附近显红色。试回答:
(1)电源的A极是_______;
(2)写出甲装置中电解反应的总方程式:_________;
(3)如果收集乙装置中产生的气体,EF两电极产生的气体的体积比是______________;
(4)欲用丙装置给铜镀银,G应该是_______(填化学式)
(5)若乙装置共收集到标况下448mL气体,则H电极质量变化_________g
有机分子中,不同氢原子在NMR中对应不同的峰(信号),且峰的强度与分子中同类氢原子个数成正比。例如丙烷分子有两种不同的H(甲基中的H和亚甲基中的H),NMR有两个峰,且两个峰的强度比为6∶2(或写成3∶1,前者为甲基上氢对应的峰,后者为亚甲基上氢对应的峰);同理,甲醇分子的PMR有两个峰,且强度比为3∶1。
⑴苯甲酸(-COOH)分子的PMR有个峰。
⑵ 在运用NMR谱确定C3H6O结构时,在核磁共振谱上给出的峰有两组其中一组只有一个信号峰,该组信号峰对应物质的结构简式为,另一组有三个信号峰,则三个信号峰的强度比为,分析中还发现一组也有三个信号峰,三个信号峰的强度比为1:1:4,则该物质的结构简式可能为
(12分)人们对苯及芳香烃的认识有一个不断深化的过程。
⑴由于苯的含碳量与乙炔相同,人们认为它是一种不饱和烃,写出分子式为 C6H6 的一种含两个叁键且无支链链烃的结构简式。
⑵已知分子式为 C6H6 的结构有多种,其中的两种为
①这两种结构的区别表现在:
定性方面(即化学性质方面):Ⅱ能_______(选填a、b、c、d,多选扣分)而Ⅰ不能
a、被酸性高锰酸钾溶液氧化 b、能与溴水发生加成反应,
c、能与溴发生取代反应 d、能与氢气发生加成反应
定量方面(即消耗反应物的量的方面):1 mol C6H6 与H2加成时:
Ⅰ需______mol,而Ⅱ需 _______mol。
②今发现 C6H6还可能有另一种如右图立体结构:该结构的二氯代物有_______种。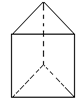
⑶萘也是一种芳香烃,它的分子式是 C10H8 ,请你判断,它的结构简式可能是下列中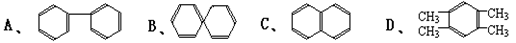 的_____(填入编号)
的_____(填入编号)