请写出含碳92.3%的某烃最简式 。写出2种具有该最简式的烃的结构简式 , 。将苯分子中的1个碳原子换成氮原子,得到另一种稳定的有机化合物,其分子量为 。
(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如图所示。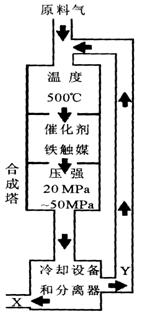
①X的化学式为;
②上图中条件选定的主要 原因是(选填字母序号);
原因是(选填字母序号);
A.温度、压强对化学平衡影响B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
③改变反应条件,会使平衡发生移动。下图表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是(选填字母代号),当横坐标为温度时,变化趋势正确的是(选填字母序号)。
(2)常温下氨气极易溶于水,其水溶液可以导电。
①用方程式表示氨气溶于水的过程中存在的可逆反应
,
②氨水中水电离出的c(OH-) 10-7mol/L(填写“>”、“<”或“=”);
③将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大以小依次为。
(3)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成A和B两种物质。A为铵盐,B在标准状况下为气态。在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96L氨气(标准状况),同时生成0.3molA。
①写出氨气和氟气反应的化学方程式;
②在标准状况下,每生成1 mol B,转移电子的物质的量为mol。
以石油裂解气为原料,通过一系列化学反应可得到重要的化工产品增塑剂G。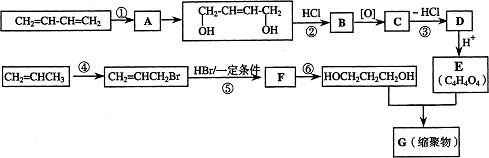
请完成下列各题:
(1)写出反应类型:反应①,反应④。
(2)写出反应条件:反应③,反应⑥。
(3)反应②③的目的是:。
(4)写出反应⑤的化学方程式:。
(5)B被氧化成C的过程中会有中间产物生成,该中间产物可能是(写出一种物质的结构简式),检验该物质存在的试剂是。
(6)写出G的结构简式。
芳香族化合物A广泛存在于植物中,具有光敏性、抗菌和消炎作用。经实验测定,A由碳、氢、氧三种元素组成,相对分子质量小于200,其中碳、氢元素的质量分数之和为78.1%。经红外光谱测定,在A的结构中存在C=O双键和C−O单键,不含O−H。A经下列步骤转变为乙二酸和水杨酸。
已知:(1)Mr(B)=Mr(A)+18,Mr(C)=Mr(B)+14;[Mr(X)表示物质X的相对分子质量]
(2)CH3CH2CH=CHCH3 CH3CH2COOH+CH3COOH
CH3CH2COOH+CH3COOH
请回答下列问题:
(1)请写出A的分子式 ▲;
(2)写出“A —→ B反应”的化学方程式: ▲;
“D —→水杨酸”的反应类型是 ▲。
(3)在上述转化过程中,设计反应步骤“B—→ C”的目的是 ▲。
(4)聚乙二酸丁二醇酯(PBSA)是目前正在实用化的生物降解性塑料之一,可以用于生产食品容器及包装材料。请写出乙二酸与1,4-丁二醇(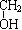 CH2CH2
CH2CH2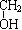 )反应合成PBSA的化学方程式: ▲。
)反应合成PBSA的化学方程式: ▲。
(5)化合物D有多种同分异构体,其中一类同分异构体具有如下特点:
①苯的二取代物,且其苯环上的一氯代物有两种。
②能发生银镜反应,与氯化铁溶液发生显色反应。
请写出这类同分异构体的任意两种结构简式: ▲。
一种“人工固氮”的新方法是在光照条件下,N2在催化剂表面与水蒸气发生反应生成NH3和氧气。已知:
| 化学键 |
N≡N |
H—O |
N—H |
O=O |
| 键能/kJ·mol-1 |
945 |
463 |
391 |
498 |
(1)请根据以上信息,写出“人工固氮”新方法的热化学方程式:_____▲______;
(2)进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3 h):
| T/℃ |
30 |
40 |
50 |
| 生成NH3量/(10-6mo1/L) |
4.8 |
5.9 |
6.0 |
①50℃时从开始到3 h内以O2物质的量浓度变化表示的平均反应速率为 ▲;
②与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议(请写出两条) ▲、 ▲;
(3)氨是氮肥工业的重要原料。某化肥厂生产铵态氮肥(NH4)2SO4的工业流程如下: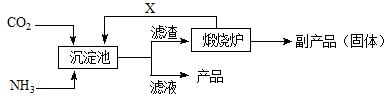
①往沉淀池中装入CaSO4悬浊液后,需先通入足量NH3,再通入CO2的原因是
▲。
②煅烧炉中产生的固态副产品为 ▲,生产流程中能被循环利用的物质X为 ▲。
化合物A是尿路结石的主要成分,属于结晶水合物,可用X·H2O表示。在一定条件下有如下图所示的转化关系: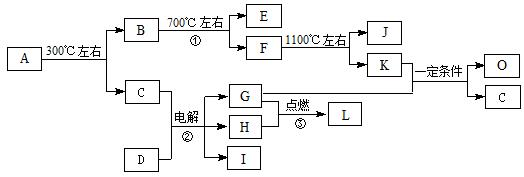
已知:
①经分析,上图中的各字母代表的物质均由常见元素(原子序数≤20)组成,其中X由三种元素组成;A、D晶体中阴、阳离子个数比都是1∶1;D中的阳离子与C分子有相同的电子数,A中的阳离子与D中的阴离子的电子层结构相同。
② G、H是常见的气体单质,E、K、L是常见的气体化合物;E被人体吸入会与血红蛋白结合而使人中毒,K的大量排放是造成地球温室效应的一个主要原因。
③反应②、③是重要的化工反应,I是一种重要的化工原料。
④上图中的部分变化经定量测定,得到如下图所示的固体产物的质量分数[ω(%)]随温度[T(℃)]的变化曲线。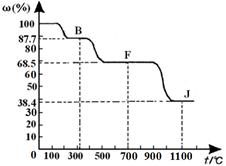
回答下列问题:
(1)写出A的化学式: ▲,D中阴离子的结构示意图为 ▲;
(2)反应①的化学方程式为: ▲。
(3)写出电解反应②的化学方程式,并标出电子转移的方向和数目: ▲。
(4)K与G在一定条件下可生成多种物质,既可获得经济效益,也减少对环境的污染。
①若O是一种易挥发的液态燃料,有毒,误饮5-10mL会导致双目失明。则O的分子式为: ▲。
②若O是K与G按1∶3的比例反应而得,则O可能是 ▲。(填编号)
A.烷烃 B.烯烃 C.炔烃 D.芳香烃