太阳能电池的发展已经进入了第三代。第三代就是铜铟镓硒CIGS等化合物薄膜太阳能电池以及薄膜Si系太阳能电池。完成下列填空:
(1)亚铜离子(Cu+)基态时的电子排布式为 。
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为 (用元素符号表示),用原子结构观点加以解释 。
(3)与镓元素处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成加合物,如BF3能与NH3反应生成BF3·NH3。BF3·NH3中B原子的杂化轨道类型为 ,B与N之间形成 键。 
(4)单晶硅的结构与金刚石相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子不成键,则得上图所示的金刚砂(SiC)结构;在SiC中,每个C原子周围最近的C原子数目为 。
已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| |温度/ ℃ |
700 |
800 |
830 |
1000 |
1200 |
| 平衡常数 |
1.7 |
1.1 |
1.0 |
0.6 |
0.4 |
回答下列问题:
(1)该反应的△H 0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003mol·L-1·s-1。,则6s时c(A)= mol·L-1,C的物质的量为 mol;若反应经一段时间后,达到平衡时A的转化率为 ;
(3)1200℃时反应C(g)+D(g)  A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。
(1)已知Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O,甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下(所取溶液体积均为10 mL):
| 实验编号 |
实验温度/℃ |
c(Na2S2O3)/ (mol·L-1) |
c(H2SO4)/ (mol·L-1) |
| ① |
25 |
0.1 |
0.1 |
| ② |
25 |
0.2 |
0.1 |
| ③ |
25 |
0.1 |
0.2 |
| ④ |
50 |
0.2 |
0.1 |
| ⑤ |
50 |
0.1 |
0.1 |
其他条件不变时:探究温度对化学反应速率的影响,应选择实验__________________(填实验编号);若同时选择实验①、实验②、实验③,测定混合液变浑浊的时间,可探究______________________对化学反应速率的影响。
(2)已知2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久反应速率明显增大,溶液很快褪色。
针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是_______________________________的影响。
若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以选择在反应开始前是否加入________(填字母序号)做对比实验。
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水
硼、镁及其化合物在工农业生产中应用广泛。
已知:硼镁矿主要成分为Mg2B2O5•H2O,硼砂的化学式为Na2B4O7•10H2O。利用硼镁矿制取金属镁及粗硼的工艺流程为:
回答下列有关问题:
(1)硼砂溶于热水后,常用H2SO4调pH2~3制取H3BO3,反应的离子方程式为 。X为H3BO3晶体加热脱水的产物,其与Mg制取粗硼的化学方程式为 。
(2)MgCl2·7H2O需要在HCl氛围中加热,其目的是 。若用惰性电极电解MgCl2溶液,其阴极反应式为 。
(3)镁-H2O2酸性燃料电池的反应机理为Mg+H2O2+2H+==Mg2++2H2O,则正极反应式为 。若起始电解质溶液pH=1,则pH=2时溶液中Mg2+离子浓度为 。已知Ksp[Mg(OH)2]=5.6 10-12,当溶液pH=6时 (填“有”或“没有”)Mg(OH)2沉淀析出。
10-12,当溶液pH=6时 (填“有”或“没有”)Mg(OH)2沉淀析出。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将 0.020g粗硼制成的BI3完全分解,生成的I2用0.30mol·L-1Na2S2O3(H2S2O3为弱酸)溶液滴定至终点,消耗Na2S2O3溶液18.00mL。盛装Na2S2O3溶液的仪器应为 滴定管(填“酸式”或“碱式”)。该粗硼样品的纯度为 。(提示:I2+2S2O32-=2I-+S4O62-)
Ⅰ、NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其原理是____________________________________________(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol·L-1的NH4Al(SO4)2中c(NH)________(填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH)。
(3)均为0.1 mol·L-1的几种电解质溶液的pH随温度变化的曲线如图所示。
①其中符合0.1mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是________,导致pH随温度变化的原因是__________________________________;
②20℃时,0.1mol·L-1的NH4Al(SO4)2中2c(SO)-c(NH)-3c(Al3+)=________(取近似值)
(4)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示:
试分析图中a、b、c、d四个点,水的电离程度最大的是________点;在b点,溶液中各离子浓度由大到小的排列顺序是_______________________________
Ⅱ、为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN > AgI。
| 操作步骤 |
现象 |
| 步骤1:向2 mL 0.005 mol·L-1 AgNO3溶液中加入2 mL 0.005 mol·L-1 KSCN溶液,静置。 |
出现白色沉淀。 |
| 步骤2:取1 mL上层清液于试管中,滴加1滴2mol·L-1 Fe(NO3)3溶液。 |
溶液变红色。 |
| 步骤3:向步骤2的溶液中,继续加入5滴3 mol·L-1 AgNO3溶液。 |
现象a,溶液红色变浅。 |
| 步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1 KI溶液。 |
出现黄色沉淀。 |
(1)写出步骤2中溶液变红色的离子方程式 。
(2)步骤3中现象a 。
(3)用化学平衡原理解释步骤4的实验现象
对含氮物质的研究和利用有着极为重要的意义。
(1)N2、O2和H2相互之间可以发生化合反应,已知反应的热化学方程式如下:
N2(g)+O2(g)=2NO(g) H=+180.5kJ·mol-1;
H=+180.5kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) H =-483.6 kJ·mol-1;
H =-483.6 kJ·mol-1;
N2(g)+3H2(g)=2NH3(g) H =-92.4 kJ·mol-1。
H =-92.4 kJ·mol-1。
则氨的催化氧化反应的热化学方程式为 _。
(2)氨气是化工生产的主要原料之一,在一固定容积为2L的密闭容器内加入0.2 mol N2和0.5mol H2,发生如下反应: N2(g)+3H2(g) 2NH3(g) △H<0
2NH3(g) △H<0
①当反应进行到第5分钟时达到平衡,测得NH3的浓度为0.1mol/L则从反应开始到平衡时,v(N2)为______________
②下列描述中能说明上述反应已达平衡的是
A.容器内的总压强不再随时间而变化
B.混合气体的密度不再随时间变化
C.a molN≡N键断裂的同时,有6amolN—H键生成
D.N2、H2、NH3的分子数之比为1∶3∶2
E.3V正(H2)=2V逆(NH3)
F.容器中气体的平均分子量不随时间而变化
③若保持反应温度不变,再向容器中充入N2和NH3各0.1mol , 则化学平衡将 移动(填“向左”、“向右”或“不”)
④平衡后,下列措施既能提高该反应的速率又能增大N2的转化率的是()
A.充入N2 B.升高温度 C.向原容器内继续充一定量NH3 D.增大压强
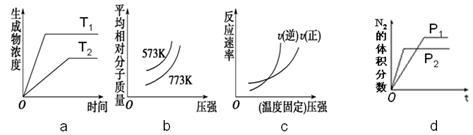
⑤若保持容器体积不变,下列图像正确的是()