在1.0 L密闭容器中放入0.10 mol A(g),在一定温度进行如下反应:
A(g) B(g)+C(g) ΔH=+85.1 kJ·mol-1
B(g)+C(g) ΔH=+85.1 kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h |
0 |
1 |
2 |
4 |
8 |
16 |
20 |
25 |
30 |
| 总压强p/100 kPa |
4.91 |
5.58 |
6.32 |
7.31 |
8.54 |
9.50 |
9.52 |
9.53 |
9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为____________。
(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为______________。平衡时A的转化率为__________,列式并计算反应的平衡常数K__________。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n(总)=____ mol,n(A)=________ mol。
②下表为反应物A浓度与反应时间的数据,计算:a=________。
| 反应时间t/h |
0 |
4 |
8 |
16 |
| c(A)/(mol·L-1) |
0.10 |
a |
0.026 |
0.006 5 |
分析该反应中反应物的浓度c(A)变化与时间间隔(Δt)的规律,得出的结论是________________________________,由此规律推出反应在12 h时反应物的浓度c(A)为__________ mol·L-1。
“冶炼金属常用以下几种方法:
①热还原法②离子交换法③电渗析法④电解法⑤热分解法。
下列金属各采用哪种方法还原最佳(用序号填写下列空白)。
(1)Na、、Al等活泼或较活泼金属。(2)Hg、Ag等不活泼金属。
(3)Fe、Zn等金属______________________
下面列出了几组物质,请将物质的合适组号填写在空格上。
| A.金刚石与石墨; | B.淀粉和纤维素; | C.氕与氘 | D.甲烷与戊烷; |
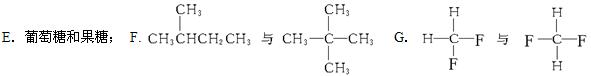
(1)同位素;(2)同素异形体;
(3)同系物;(4)同分异构体;
(5)同一物质。
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用下图所示的装置制取乙酸乙酯。回答下列问题: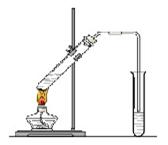
⑴写出制取乙酸乙酯的化学反应方程式:
。
⑵饱和碳酸钠溶液的主要作用是:。
。
⑶装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止 。
⑷做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是 。
C5H12有3种同分异构体,写出这3种同分异构体的结构简式:
书写下列反应的方程式:
(1)乙醇与金属钠反应:
(2)乙醇的催化氧化:
(3)苯与液溴反应: