向一容积不变的密闭容器中充入一定量A和B,发生反应:xA(g)+2B(s) yC(g) ΔH<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
yC(g) ΔH<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
(1)用A的浓度变化表示该反应0~10 min内的平均反应速率v(A)=________。
(2)根据图示可确定x∶y=________。
(3)0~10 min容器内压强________(填“变大”、“不变”或“变小”)。
(4)推测第10 min引起曲线变化的反应条件可能是________;第16 min引起曲线变化的反应条件可能是________。
①减压 ②增大A的浓度 ③增大C的量 ④升温
⑤降温 ⑥加催化剂
(5)若平衡Ⅰ的平衡常数为K1,平衡Ⅱ的平衡常数为K2,则K1________K2(填“>”、“=”或“<”)。
根据下列几种粒子的结构示意图,回答问题:(填粒子代号)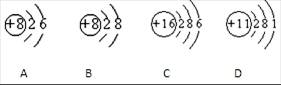
(1)其中属于阴离子的是,
(2)属于金属元素的是,
(3)具有相似化学性质的是。
Ca(ClO)2与浓盐酸反应会生成Cl2,该反应的化学方程式为:
Ca(ClO)2 + 4HCl(浓)= CaCl2 + 2Cl2↑ + 2H2O
(1)浓盐酸在反应中显示出来的性质是(填写字母)
| A.只有还原性 | B.还原性和酸性 |
| C.只有氧化性 | D.氧化性和酸性 |
(2)产生0.3mol Cl2,则转移的电子的物质的量为
(3)用双线桥法表示该氧化还原反应中电子转移的方向和数目
用18 mol·L-1浓硫酸配制100 mL 1.0 mol·L-1稀硫酸的实验。 回答下列问题:
(1)所需浓硫酸的体积是mL (保留一位小数);
(2)现有下列几种规格的仪器,应选用
①10mL量筒②50 mL量筒③100mL量筒④100mL容量瓶⑤250mL容量
(3)下列情况对所配制的稀硫酸浓度有何影响?(填写“偏大”、“偏小”或“无影响”)
①稀释浓硫酸后立刻转移到容量瓶中定容;
②容量瓶用蒸馏水洗涤后没干燥就开始移液;
③量取浓硫酸时俯视量筒刻度线;
④定容时俯视容量瓶刻度线;
脱羧反应形成新的C-C键为有机合成提供了一条新的途径,例如: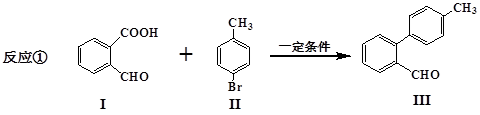
(1)化合物I的分子式为_________,化合物I含有的官能团名称是______________,
(2)化合物III与新制氢氧化铜反应的化学方程式为________________________。
(3)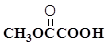 与
与 也可以发生类似反应①的反应,有机产物的结构简式为:_________________________。
也可以发生类似反应①的反应,有机产物的结构简式为:_________________________。
(4)化合物I有多种同分异构体,请写出任意2种符合下列条件的同分异构体的结构简式:___________。(要求:①能与FeCl3溶液发生显色反应;②苯环上一氯取代产物有2种)
(12分)对二甲苯(英文名称p-xylene,缩写为PX)是一种低毒化合物,也是聚酯工业的重要原料,主要用于生产对苯二甲酸(PTA),对苯二甲酸再和乙二醇(EG)反应生成聚对苯二甲酸乙二醇酯(PET)。国内对二甲苯产量增长步伐放缓,供应缺口加大,近一半的PX依靠进口。以PX为主要原料生产PET的一种路线如下: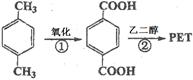
(1)PX可以发生的反应类型有加成反应、、。(填反应类型)
(2)PX的核磁共振氢谱有组峰,峰面积之比为。
(3)反应②的化学方程式为。(不用注明条件)
(4)PX的来源之一是煤的干馏。已知煤干馏副产物煤焦油主要成分有苯、甲苯、混合二甲苯、酚类等,从煤焦油中分离提纯对二甲苯的方法是。
(5)“甲苯甲醇烷基化”制备对二甲苯是一条增产PX的新工艺路线: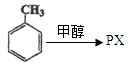
写出该反应的化学方程式:。(不用注明条件)
(6)PTA的一种同分异构体X与其含有相同官能团,且其苯环上的一氯取代物有两种,写出化合物X 与1,3-丙二醇1:1形成最简单环酯的结构简式:。