(创新预测题)将煤转化为水煤气的主要化学反应为C(s)+H2O(g)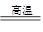 CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
H2(g)+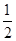 O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
CO(g)+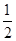 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
请回答:
(1)根据以上数据,写出C(s)与水蒸气反应的热化学反应方程式:_____________________________。
(2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出如图循环图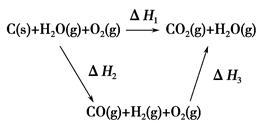
并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。
请分析:甲、乙两同学观点正确的是________(填“甲”或“乙”);判断的理由是
_______________________________________________________。
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点______________________________________________________
水处理技术在生产、生活中应用广泛。
(1)含有较多离子的水称为硬水。硬水加热后产生碳酸盐沉淀的离子方程式为(写出一个即可)。
(2)将RH型阳离子交换树脂和ROH型阴离子交换树脂串接来软化天然硬水,应先使硬水通过(填“RH”或“ROH”)型离子交换树脂,原因是。
(3)通过施加一定压力使水分子通过半透膜而将大分子或离子截留,从而获得纯净水的方法称为。电渗析法净化水时,使离子通过半透膜的推动力是。
(4)检验蒸馏水的纯度时,最简单易行的方法是测定水的。
日本地震之后的核危机,导致我国不少地方出现了食盐抢购风潮。食盐既是生活中必不可少的调味品,也是一种非常重要的化工原料。
(1)按原料来源分类,可将食盐分为海盐、湖盐和井矿盐。海水晒盐的原理与化学实验中的(填一种实验操作的名称)原理相似,该过程是变化(填“物理”或“化学”)。
(2)氯碱工业是对食盐资源进行综合利用的基础。
①电解食盐水之前需要对食盐进行精制。为有效除去工业食盐中的Ca2+、Mg2+、SO42-,加入试剂的合理顺序为。
a.先加NaOH,然后加Na2CO3,最后加钡试剂
b.先加NaOH,然后加钡试剂,最后加Na2CO3
c.先加钡试剂,然后加NaOH,最后加Na2CO3
②离子交换膜电解槽中,离子交换膜的作用是。
③氯碱工业的选址比较特殊,通常不会单独建氯碱化工厂,而是与农药厂、有机化工厂、制药厂、盐酸厂等建在一起,请分析这种建厂方式的原因:。
(3)侯氏制碱法生产工艺中要用到大量食盐。侯氏制碱法原理与索尔维法基本相同,不同之处是在析出碳酸氢钠后的母液中继续加入食盐,通入氨气,使氯化铵析出,从而得到了两种物质:碳酸钠和氯化铵。该循环工艺流程如下: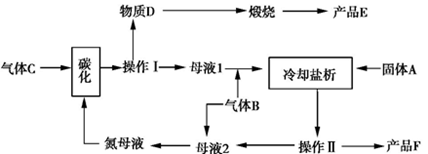
①气体B的分子式为。向饱和食盐水中应先通入再通入(填气体名称)才能得到物质D。
②上述生产过程中能循环使用的物质是:C、B、F、、(填物质编号)。
“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂联合生产等都是很好的“低碳”生产方式。下面是几家工厂利用废气、废液、废渣联合生产化肥硫酸铵的工艺: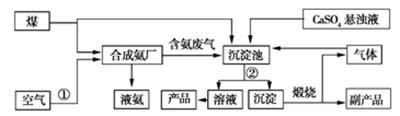
请回答下列问题:
(1)操作②为。
(2)工业合成氨的化学方程式为。
(3)沉淀池中生成硫酸铵的化学方程式为。
(4)在实验室中检验氨气的方法是。
(5)副产品的化学式为。该联合生产工艺中可以循环使用的物质是。
针对下面9种元素,完成以下各小题
| 周期 |
IA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
O |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
(1)单质为有色气体的元素是___________(填名称)。
(2)③与④⑤简单离子的半径由大到小的顺序为___________(填离子符号)。
(3)元素②的单质的电子式为__________。
(4)最高价氧化物对应的水化物酸性最强的是___________________。(填化学式)
(5)④和⑥的最高价氧化物对应的水化物反应的离子方程式为___________。
(6)⑦的单质的用途正确的是___________。
A.光导纤维 B.太阳能电池 C.普通玻璃 D.计算机芯片
(7)元素①和⑦非金属性较强的是____,写出一个能表示二者非金属性强弱关系的化学方程式为:__________。
钮扣电池的电极材料为Zn和Ag2O,电解质溶液为KOH,其电极反应为:
Zn + 2OH--2e- =" ZnO" + H2O Ag2O + H2O + 2e- =" 2Ag" + 2OH-
电池的负极是(填电极材料),正极发生的是反应(填反应类型),
总反应式为。