日本地震之后的核危机,导致我国不少地方出现了食盐抢购风潮。食盐既是生活中必不可少的调味品,也是一种非常重要的化工原料。
(1)按原料来源分类,可将食盐分为海盐、湖盐和井矿盐。海水晒盐的原理与化学实验中的 (填一种实验操作的名称)原理相似,该过程是 变化(填“物理”或“化学”)。
(2)氯碱工业是对食盐资源进行综合利用的基础。
①电解食盐水之前需要对食盐进行精制。为有效除去工业食盐中的Ca2+、Mg2+、SO42-,加入试剂的合理顺序为 。
a.先加NaOH,然后加Na2CO3,最后加钡试剂
b.先加NaOH,然后加钡试剂,最后加Na2CO3
c.先加钡试剂,然后加NaOH,最后加Na2CO3
②离子交换膜电解槽中,离子交换膜的作用是 。
③氯碱工业的选址比较特殊,通常不会单独建氯碱化工厂,而是与农药厂、有机化工厂、制药厂、盐酸厂等建在一起,请分析这种建厂方式的原因: 。
(3)侯氏制碱法生产工艺中要用到大量食盐。侯氏制碱法原理与索尔维法基本相同,不同之处是在析出碳酸氢钠后的母液中继续加入食盐,通入氨气,使氯化铵析出,从而得到了两种物质:碳酸钠和氯化铵。该循环工艺流程如下: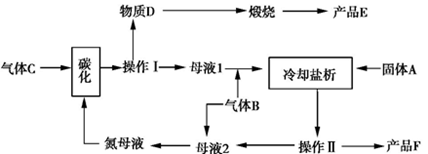
①气体B的分子式为 。向饱和食盐水中应先通入 再通入 (填气体名称)才能得到物质D。
②上述生产过程中能循环使用的物质是:C、B、F、 、 (填物质编号)。
已知H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)NaHA溶液(填“显酸性”、“显碱性”、“显中性”或“酸碱性无法确定”)。
(2)某温度下,若向0.1 mol/L的NaHA溶液中滴入0.1 mol/L KOH溶液使混合溶液中c(H+)=c(OH-),则此时该混合溶液中,下列关系一定正确的是(填字母)。
A.c(H+)·c(OH-)=1×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)="0.05" mol/L
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s) Ca2+(aq)+A2-(aq)ΔH>0
Ca2+(aq)+A2-(aq)ΔH>0
①温度升高时,Ksp(填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+)。
(4)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式:。
依据题目要求回答下列问题。
(1)常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如表所示。
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
①上述盐溶液中的阴离子结合H+能力最强的是。
②根据表中数据,浓度均为0.01 mol·L-1的下列五种物质的溶液中,酸性最强的是(填字母编号,下同);将各溶液分别稀释100倍,pH变化最小的是。
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
③根据上表数据,请你判断下列反应不能成立的是。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+NaClO=NaHCO3+HClO
D.CO2+H2O+2C6H5Ona=Na2CO3+2C6H5OH
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸氢钠溶液,反应的离子方程式为。
(2)已知常温下Cu(OH)2的Ksp=2×10-20。又知常温下某CuSO4溶液中c(Cu2+)="0.02" mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液的pH大于。
(1)常温下,如果取0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合,测得混合液的pH=8。混合液中由水电离出的OH-浓度与0.1 mol·L-1 NaOH溶液中由水电离出的OH-浓度之比为。
(2)相同温度下,将足量硫酸钡固体分别放入相同体积的①0.1 mol·L-1硫酸铝溶液;②0.1 mol·L-1氯化钡溶液;③蒸馏水;④0.1 mol·L-1硫酸溶液中,Ba2+浓度由大到小的顺序是(用序号填写)。
(3)常温下,将a mol·L-1的氨水与0.1 mol·L-1的盐酸等体积混合,当溶液中c(N )=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数Kb=。
)=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数Kb=。
一定温度下,向一容积为5 L的恒容密闭容器中充入0.4 mol SO2和0.2 mol O2,发生反应:2SO2(g)+O2(g) 2SO3(g) ΔH="-196" kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
2SO3(g) ΔH="-196" kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
(1)判断该反应达到平衡状态的标志是(填字母)。
a.SO2、O2、SO3三者的浓度之比为2∶1∶2
b.容器内气体的压强不变
c.容器内混合气体的密度保持不变
d.SO3的物质的量不再变化
e.SO2的生成速率和SO3的生成速率相等
(2)①SO2的转化率为;②达到平衡时反应放出的热量为;③此温度下该反应的平衡常数K=。
(3)如图表示平衡时SO2的体积分数随压强和温度变化的曲线,则:
①温度关系:T1T2(填“>”、“<”或“=”,下同);
②平衡常数关系:KAKB,KAKD。
T ℃、2 L密闭容器中某一反应在不同时刻的各物质的量如图所示(E为固体,其余为气体)。回答下列问题。
(1)写出该反应的化学方程式:。
(2)反应开始至3 min时,用D表示的平均反应速率为mol·L-1·min-1。
(3)T ℃时,该反应的化学平衡常数K=。
(4)第6 min时,保持温度不变,将容器的体积缩小至原来的一半,重新达到平衡后,D的体积分数为。
(5)另有一个2 L的密闭容器,T ℃、某一时刻,容器中各物质的物质的量如表所示。
| 物质 |
A |
B |
D |
E |
| 物质的量(mol) |
0.8 |
1.0 |
0.4 |
0.2 |
此时v(正)v(逆)(填“大于”、“等于”或“小于”)。