(本小题满分9分)
(1)把6 mol A气体和5 mol B气体混合放入4 L密闭容器中,在一定条件下发生反应:3A(g)+B(g) 2C(g)+xD(g),经5min达到平衡,此时生成2 mol C,测得D的平均反应速率为0.15 mol/(L·min),则平衡时A的物质的量浓度是____________;B的转化率是__________;x的值是___________。
2C(g)+xD(g),经5min达到平衡,此时生成2 mol C,测得D的平均反应速率为0.15 mol/(L·min),则平衡时A的物质的量浓度是____________;B的转化率是__________;x的值是___________。
(2)反应2H2(g) + O2(g)= 2H2O(g)的能量变化如图所示。已知拆开1molH2、1molO2和1molH-O中的化学键分别需要消耗436KJ、496KJ和463KJ能量,则该反应 (填“吸收” 或“放出”) KJ热量。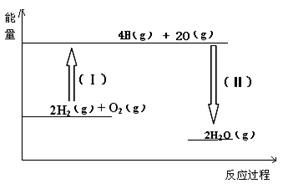
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如右图所示:
a、b两个电极均由多孔的碳块组成。写出a极的电极反应式: 。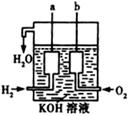
(4)工业上用电解饱和食盐水的方法制取金属氯气,反应中能量的转化形式是 ;氯气在 极上产生,反应后溶液的pH 。(填“增大”或“减小”)。
分子式为C4H8O2的物质有多种同分异构体,请写出符合下列要求的各种同分异构体的结构简式。
说明:①碳碳双键上连有羟基的结构不稳定;
②不考虑同一个碳原子上连有两个羟基的结构。
(1)甲分子中没有支链,能与NaHCO3溶液反应,则甲的结构简式为。
(2)乙可发生银镜反应,还能与钠反应,则乙可能的结构简式为________(任写一种)。
(3)1 mol丙与足量的金属钠反应能生成1 mol H2,丙还能使溴水褪色,则丙可能的结构简式为____(任写一种)。
(4)丁是一种有果香味的物质,能水解生成A、B两种有机物,A在一定条件下能转化为B,则丁的结构简式为________。
通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0% .
(1)X的电子式是;
(2)X与金属钠反应放出氢气,反应的化学方程式是(有机物用结构简式表达);
(3)X与空气中的氧气在铜或银催化下反应生成Y,Y的结构简式是;Y能发生银镜反应,Y与银氨溶液的反应的化学方程式是:。
工业上硝酸的制备和自然界中硝酸的生成既有相同之处,又有区别。路线①②③是工业生产硝酸的主要途径,路线Ⅰ、Ⅱ、Ⅲ是雷电高能固氮过程中硝酸的生成途径。
(1)写出N2的一种用途。
(2)实验室制取物质NH3的化学方程式为。
(3)写出工业制硝酸第③步反应化学方程式。
(4)硝酸是一种强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而有变化,从总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少,浓硝酸的还原产物主要为NO2,稀硝酸的还原产物主要为NO。 实验室中,常用Cu与浓HNO3反应制取NO2,用Cu与稀HNO3反应制取NO。
(ⅰ)请写出实验室中用Cu与浓HNO3反应制取NO2的化学方程式:___________。该反应中发生氧化反应的物质是_______,1 mol氧化剂_________(填“得到”或“失去”)_______ mol电子。
(ⅱ)48.0 g Cu与适量的浓HNO3反应,铜全部溶解后,共收集到标准状况下22.4 L的气体(NO2和NO的混合气体),反应中消耗HNO3的物质的量是()
| A.1.5 mol | B.2.0 mol | C.2.5 mol | D.3.0 mol |
(ⅲ)实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为N2O、N2、NH4NO3等。请将3种物质:FeSO4、Fe(NO3)3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
HNO3+ ______  ______+ ______ + N2O↑ + H2O
______+ ______ + N2O↑ + H2O
并配平其对应的离子方程式:□Fe2++□NO3-+□H+ =□Fe3++□N2O↑+□H2O
原子序数依次增大的A、B、C、D都是元素周期表中短周期元素,B、C、D同周期,A、D同主族,且A的原子结构中最外层电子数是电子层数的3倍。D的最高价氧化物对应的水化物为强酸,且B、C、D的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水。根据以上信息,回答下列问题:
(1)D元素在元素周期表中的位置为,A和B形成化合物的化学式是。
(2)高温时,C的单质跟Fe2O3发生反应的化学方程式。
(3)写出C的最高价氧化物对应的水化物与B的最高价氧化物对应的水化物反应的离子方程式。
下表为元素周期表的一部分,表中列出10种元素在周期表中的位置,按要求回答下列问题。
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
④ |
⑤ |
⑥ |
⑧ |
⑩ |
|||
| 3 |
① |
⑦ |
⑨ |
|||||
| 4 |
② |
③ |
(1)在这10种元素中,化学性质最不活泼的是(写序号),失电子能力最强的原子是_____(用元素符号表示)。
(2)在这10种元素中,最高价氧化物的水化物碱性最强的是(填化学式),最高价氧化物的水化物酸性最强的是(填化学式)。
(3)H分别与④、⑤、⑦、⑧、⑨形成的化合物中,最稳定的是(填化学式);
(4)①、⑧、⑨三种元素单核离子半径由小到大的顺序是(用相应的离子符号表示):
(5)写出③和⑨形成的化合物的电子式,化学键类型为____(“离子键”或“共价键”)。