以下分子或离子的结构为正四面体构型的是
①CH4 ②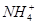 ③CH3Cl ④P4 ⑤H2S
③CH3Cl ④P4 ⑤H2S
| A.①②③ | B.①②④ | C.①②⑤ | D.①④⑤ |
下列反应中,属于取代反应的是()
①CH3CH=CH2+Br2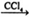 CH3CHBrCH2Br
CH3CHBrCH2Br
②CH3CH2OH 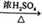 CH2=CH2↑ +H2O
CH2=CH2↑ +H2O
③CH3COOH+CH3CH2OH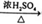 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
④C6H6+HNO3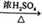 C6H5NO2+H2O
C6H5NO2+H2O
| A.①② | B.③④ | C.①③ | D.②④ |
下列各组物质中,所含元素的质量分数相同,但它们既不属于同分异构体,也不属于同系物的是()
| A.乙烯 丙烯 | B.异戊二烯 3甲基1丁炔 |
| C.甲烷 乙烯 | D.苯 苯乙烯 |
有机物CH3CH=CH—Cl能发生的反应为()
①取代反应②加成反应③消去反应④使溴的四氯化碳溶液褪色
⑤聚合反应⑥使酸性高锰酸钾溶液褪色
| A.全部 | B.除⑤外 | C.除①外 | D.除①、⑤外 |
欲观察环戊烯( )是否能使酸性KMnO4溶液褪色,先将环戊烯溶于适当的溶剂,再慢慢滴入0.005mol·L-1 KMnO4溶液并不断振荡。下列哪一种试剂最适合用来溶解环戊烯做此实验()
)是否能使酸性KMnO4溶液褪色,先将环戊烯溶于适当的溶剂,再慢慢滴入0.005mol·L-1 KMnO4溶液并不断振荡。下列哪一种试剂最适合用来溶解环戊烯做此实验()
| A.四氯化碳 | B.裂化汽油 | C.甲苯 | D.水 |
制取一氯乙烷,采用的最佳方法是()
| A.乙烷和氯气取代反应 | B.乙烯和氯气加成反应 |
| C.乙烷和HCl作用 | D.乙烯和HCl加成反应 |