在一定温度下,1 mol金属铜与足量某浓度的硝酸完全反应,生成NO2和NO的
物质的量之比为1:3,则反应过程中转移的电子总数为
| A.2 mol | B.3 mol | C.4mol | D.5 mo1 |
三氟化氮(NF3)在微电子工业中有重要用途,它在潮湿的空气中与水蒸气反应的产物有:HF、NO和HNO3。则下列说法正确的是
| A.NF3分子中含有非极性共价键 |
| B.NF3在空气中泄漏时不易被察觉 |
| C.一旦NF3泄漏,可以用石灰水溶液喷淋的方法减少污染 |
| D.反应过程中,被氧化与被还原的元素的物质的量之比为2:1 |
如图为某化学反应的速率与时间的关系示意图。在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是 ()
A.2SO2(g)+O2(g) 2SO3(g)ΔH<0 2SO3(g)ΔH<0 |
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g)ΔH<0 4NO(g)+6H2O(g)ΔH<0 |
C.H2(g)+I2(g) 2HI(g)ΔH>0 2HI(g)ΔH>0 |
D.2A(g)+B(g) 2C(g)ΔH>0 2C(g)ΔH>0 |
下列物质的转化在给定条件下能实现的是
①Al2O3 NaAlO2(aq )
NaAlO2(aq )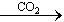 Al(OH)3
Al(OH)3
②S SO3
SO3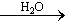 H2SO4
H2SO4
③Fe2O3 FeCl3 (aq)
FeCl3 (aq) 无水FeCl3
无水FeCl3
④饱和NaCl(aq)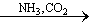 NaHCO3
NaHCO3 Na2CO3
Na2CO3
⑤MgCl2 (aq)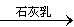 Mg(OH)2
Mg(OH)2 MgO
MgO
| A.①③⑤ | B.②③④ | C.②④⑤ | D.①④⑤ |
已知常温时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=12.0,则下列说法不正确的是 ( )
| A.所得溶液中的c(H+)=1.0×10-12 mol·L-1 |
| B.所加的烧碱溶液pH=12.0 |
| C.所得溶液中由水电离产生的c(OH-)=1.0×10-12 mol·L-1 |
| D.所得溶液中的c(Mg2+)=5.6×10-8 mol·L-1 |
下图中X、Y分别是直流电源的两极,通电后,发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的是
| a极板 |
b极板 |
X电极 |
Z溶液 |
|
| A |
银 |
铁 |
正极 |
AgNO3 |
| B |
石墨 |
石墨 |
负极 |
NaOH |
| C |
锌 |
石墨 |
负极 |
CuSO4 |
| D |
铜 |
石墨 |
负极 |
CuCl2 |