在容积固定不变的密闭容器中加入1 mol N2和3 mol H2发生反应: N2(g)+3H2(g) 2NH3(g) △H="-92.4" kJ/mol,下列结论正确的是( )
2NH3(g) △H="-92.4" kJ/mol,下列结论正确的是( )
| A.该反应达到平衡时,放出的热量等于92.4 kJ |
| B.达到平衡后向容器中通入1 mol氦气,平衡不移动 |
| C.降低温度和缩小容器体积均可使该反应的平衡常数增大 |
| D.若达到平衡时N2的转化率为20%,则平衡时容器内的压强是起始时的80% |
某可逆反应正向反应过程中能量变化如下图所示,下列说法正确的是
| A.该反应为吸热反应 |
| B.当反应达到平衡时,降低温度,A的转化率减小 |
| C.升高温度,平衡常数K增大;压强增大,平衡向正反应方向移动 |
| D.加入催化剂,反应速率增大,E1减小,E2减小,反应热不变 |
室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是
| A.溶液中导电粒子的数目减少 |
B.溶液中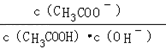 不变 不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10mLpH=11的NaOH溶液,混合液的pH=7 |
在一个密闭容器中用等物质的量的A和B发生反应:A(g)+3B(g) 2C(g),该反应达到平衡时,平衡混和气中A的体积分数为
2C(g),该反应达到平衡时,平衡混和气中A的体积分数为
| A.50% | B.60% | C.70% | D.无法计算 |
在密闭容器中进行反应CH4(g)+H2O(g) CO(g)+3H2(g) ΔH >0,测得c(CH4) 随反应时间(t)的变化如图所示。下列判断正确的是
CO(g)+3H2(g) ΔH >0,测得c(CH4) 随反应时间(t)的变化如图所示。下列判断正确的是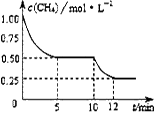
| A.0~5 min内,v(H2)=0.1 mol·(L·min)-1 |
| B.反应进行到12min时,CH4的转化率为25% |
| C.恒温下,缩小容器体积,平衡后H2浓度减小 |
| D.10 min时,改变的外界条件可能是升高温度 |
MCFC型燃料电池可同时供应电和水蒸气,其工作温度为600~700 ℃,所用燃料为H2,电解质为熔融的K2CO3。已知该电池的总反应为2H2+O2=2H2O,则下列有关该电池的说法正确的是
| A.该电池的正极反应式为4OH-+4e-=O2+2H2O |
| B.该电池的负极反应式为H2+CO32--2e-=H2O+CO2 |
| C.放电时CO32-向正极移动 |
| D.该燃料电池能量转化率很低 |