在密闭容器中进行反应CH4(g)+H2O(g) CO(g)+3H2(g) ΔH >0,测得c(CH4) 随反应时间(t)的变化如图所示。下列判断正确的是
CO(g)+3H2(g) ΔH >0,测得c(CH4) 随反应时间(t)的变化如图所示。下列判断正确的是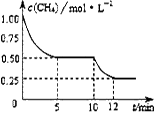
| A.0~5 min内,v(H2)=0.1 mol·(L·min)-1 |
| B.反应进行到12min时,CH4的转化率为25% |
| C.恒温下,缩小容器体积,平衡后H2浓度减小 |
| D.10 min时,改变的外界条件可能是升高温度 |
图表资料可以为我们提供很多信息,下列关于图表提供的资料或应用的说法中,不正确的是() NvQ"xKN
| A.利用元素周期表可以预测新元素的原子结构和性质MRI7 ? |
| B.根据酸、碱、盐的溶解性表,可判断酸、碱、盐的溶解度 hk]7>}eYn? |
| C.根据电负性表,可判定2种元素形成的化学键是离子键还是共价键 d:="}5JGIQ" |
| D.核磁共振氢谱可以用来测定分子中H原子种类和个数比 |
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构如右下图所示。S2Cl2遇水易水解,并产生能使品红褪色的气体。下列说法中错误的是()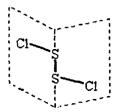

A.S2Cl2固体为分子晶体 |
||
B.S2Cl2为含有极性键和非极性键的非极性分子 |
C.S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2 |
D.S2Cl2中硫元素化合价为+1,与H2O反应可能属于氧化还原反应,方程式如下: 2S2Cl2+2H2O=SO2↑+3S↓+4HCl 2S2Cl2+2H2O=SO2↑+3S↓+4HCl |
由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH=1,c(Al3+)=0.4mol·L-1,c(SO42-)=0.8mol·L-1,则c(K+)为( )
| A.0.15 mol·L-1 | B.0.2 mol·L-1 | C.0.3 mol·L-1 | D.0.4 mol·L-1 |
对H2O的电离平衡不产生影响的粒子是()
A.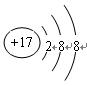 |
B.M3+离子核外电子排布式:[Ar]3d5 |
C.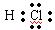 |
D.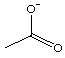 |
把1mL0.1mol/L的H2SO4加水稀释制成2L溶液,在此溶液中由水电离产生的H+,其浓度接近于()
A.1×10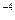 mol/L mol/L |
B.1×10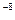 mol/L mol/L |
C.1×10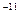 mol/L mol/L |
D.1×10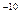 mol/L mol/L |