可以在实验室制取氨气的方法是( )
| A.将浓氨水滴在CaO固体上 | B.NH4Cl溶液和NaOH稀溶液混合 |
| C.NH4Cl晶体加热分解 | D.加热熟石灰和NH4Cl的固体混合物 |
将等质量的a.b两份锌粉装入试管中,分别加入过量的稀硫酸,同时向装a的试管中加入少量CuSO4溶液。下图表示产生氢气的体积V与时间t的关系,其中正确的是
如图两个电解槽中,A.B.C.D均为石墨电极。若电解过程中共有0.02 mol电子通过,下列叙述中正确的是( ) 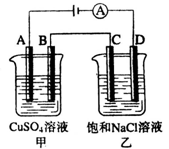
A.甲烧杯中A极上最多可析出铜1.28 g
B.甲烧杯中B极上电极反应式4OH--4e-→2H2O+O2↑
C.乙烧杯中滴入酚酞试液,D极附近先变红
D.烧杯中C极上电极反应式为4H++4e-→2H2↑
某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池反应为:Li+LiMn2O4==Li2Mn2O4。下列说法正确的是
| A.放电时,Li发生还原反应 | B.放电时,正极反应为:Li++LiMn2O4+e-==Li2Mn2O4 |
| C.充电时,LiMn2O4发生氧化反应 | D.充电时,阳极反应为:Li++e-==Li |
已知 (1)H2(g)+1/2O2(g)=H2O(g)△H1=a kJ·mol-1
(2)2H2(g)+O2(g)=2H2O(g)△H2=b kJ·mol-1
(3)H2(g)+1/2O2(g)=H2O(l)△H3=c kJ·mol-1
(4)2H2(g)+O2(g)=2H2O(l)△H4=d kJ·mol-1
下列关系式中正确的是
| A.a<c<0 | B.b>d>0 | C.2a=b<0 | D.2c=d>0 |
pH = a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH >a,则该电解质可能是
| A.NaOH | B.H2SO4 | C.AgNO3 | D.Na2SO4 |