铁生锈是比较常见的现象,某实验小组,为研究铁生锈的条件,设计了以下快速.易行的方法: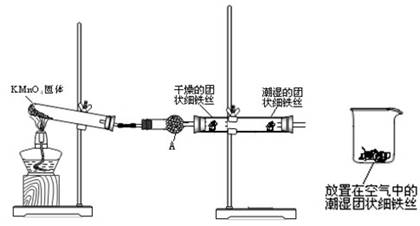

首先检查制氧气装置的气密性,然后按图连接好装置,点燃酒精灯给药品加热,持续3分钟左右,观察到的实验现象为:①直形管中用蒸馏水浸过的光亮铁丝表面颜色变得灰暗,发生锈蚀;②直形管中干燥的铁丝表面依然光亮,没有发生锈蚀;③中潮湿的铁丝依然光亮。
试回答以下问题:
(1)由于与接触的介质不同,金属腐蚀分成不同类型,本实验中铁生锈属于___________。
能表示其原理的反应方程式为_____________________________________
(2)仪器A的名称为______________,其中装的药品可以是_____ __________,其作用是___________________________________________
(3)由实验可知,该类铁生锈的条件为_______________________________________。决定铁生锈快慢的一个重要因素是_____________________________________________
ClO2是一种国际上公认的安全无毒的绿色水处理剂。回答下列问题:
(1)工业废水的处理:
某实验兴趣小组通过右图装置制备ClO2,并用它来处理Wg某T业废水(含Mn2+、CN-等)。
已知:i.ClO2为黄绿色气体,极易溶于水,沸点11℃;
ii.ClO2易爆炸,若用“惰性气体”等稀释时,爆炸性则大大降低;
iii.某T业废水处理过程中Mn2+转化为MnO2、CN-转化为对大气无污染的气体;
iv.装置B中发生的反应为:H2C2O4+H2SO4+2KClO3=K2SO4+2CO2++2C1O2+H2O.
①A装置的名称是 ,C装置的作用为 。
②用H2C2O4溶液、稀硫酸和KC1O3制备ClO2的最大优点是 。
③写出装置D中除去Mn2+的离子方程式 。
④E装置中盛放的试剂可选用 (填标号)。
a.CCl4 b.H2O c.稀盐酸d.NaOH溶液
(2)废水中CN-含量的测定:
另取工业废水W g于锥形瓶中,加入10 mL0.10 mol/L的硫酸溶液,用0.020 0 mol/L的KMnO4标准溶液进行滴定,当达到终点时共消耗KMnO4标准溶液25. 00 mL。在此过程中:
①使用棕色滴定管的原因是 ,滴定终点的判断依据是________________。
②W g 工业废水中CN-的含量为 mol。
③若滴定管在盛放标准溶液前未用标准液润洗,则测定结果将(填“偏高”、“偏低” 或“无影响”)。
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题:
(1)下列方法中,可制得的正确组合是__________。
①MnO2和浓盐酸混合共热;②MnO2、NaCl和浓硫酸混合共热:
③NaClO和浓盐酸混合;④K2Cr2O7和浓盐酸混合:
⑤KClO3和浓盐酸混合共热;⑥KMnO4和浓盐酸混合。
A.①②⑥ B.②④⑥ C.①④⑥ D.全部可以
(2)写出实验室制取Cl2的离子方程式____________。
(3)若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制得Cl2的体积(标况下)总是小于1.12L的原因是__________________________。
(4)①装置B的作用是__________________。
②装置C和D出现的不同现象说明的问题是_______________。
③装置E的作用是_____________________。
(5)乙同学认为甲同学的实验有缺陷,不能确定最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出应该在装置__________与________之间(填装置字母序号)增加一个装置,增加装置里面的试剂可为____________。
A.湿润的淀粉KI试纸 B.氢氧化钠溶液
C.湿润的红色布条D.饱和的食盐水
天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻污染。
资料:氰化钠化学式NaCN(C元素+2价,N元素-3价),白色结晶颗粒、易潮解、有微弱的苦杏仁气味、剧毒、易溶于水、易水解生成氰化氢、水溶液呈碱性。
(1)氰化钠(NaCN)溶液呈碱性,其原因是____________(用离子方程式解释)。
(2)“8.12”爆炸事故后,当地政府组织群众用双氧水喷洒,用双氧水处理NaCN产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,写出该反应的化学方程式____ 。
某化学兴趣小组在实验室制备硫代硫酸钠,并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
【实验一】实验室通过如右图所示装置制备Na2S2O3。
(3)右图a装置中盛装Na2SO3
固体的仪器名称是______________;
b装置的作用是________________。
(4)装置c中的产物有Na2S2O3和C02气体等,实验结束后,装置d中的溶质有NaOH、Na2CO3,还可能有________________________。
(5)实验结束后,在e处最好连接盛______________(选填“NaOH溶液”、“水”、“CCl4”中任一种)的注射器,再关闭K2打开K1,防止拆除装置时污染空气。
【实验二】测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。已知:
①废水中氰化钠的最高排放标准为0.50 mg/L。
② AgI呈黄色,且CN -优先与Ag+反应。
AgI呈黄色,且CN -优先与Ag+反应。
实验如下:
取25.00 mL处理后的氰化钠废水于锥形瓶中并滴加几滴KI溶液作指示剂,用1.000 ×10-4 mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为2.50 mL。
(6)滴定终点的判断方法是_______________。
(7)处理后的废水中氰化钠的含量为_____________mg/L。
X、Y、Z、W为电子数相同的分子或离子。X有5个原子核。通常状况下,W为无色液体。它们之间转化关系如图所示,请回答:
(1)实验室采用固件加热制取Z的化学方程式为: 。
(2)某化学小组同学模拟工业生产制取HNO3,设计下图所示装置,其中a为一个可持续鼓入空气的橡皮球。
①A中发生反应的化学方程式是 。
②B中浓H2SO4的作用是 。
(3)写出D装置中反应的化学方程式 。
(4)向含有ag HNO3的稀溶液中,加入bg铁粉充分反应,铁粉全部溶解。已知 ,则被还原的HNO3的质量为 g。
,则被还原的HNO3的质量为 g。
一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中回收氧化钴(CoO)的工艺流程如下: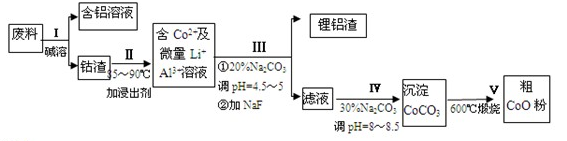
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的化学反应方程式为(产物中只有一种酸根) 。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因_____ ___。
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式____________________。
(4)碳酸钠溶液在过程III和IV中所起作用有所不同,请写出在过程IV中起的作用是__ __。
(5)在Na2CO3溶液中存在多种离子,各种离子的浓度由大到小顺序为_ 。
(6)CoO溶于盐酸可得粉红色的CoCl2溶液。CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。下图是粉红色的CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,B物质的化学式是___ ___。