最近医学界通过用放射性15C跟踪标记C60,发现一种C60的羧酸衍生物在特定条件下可通过断裂DNA杀死细胞,从而抑制艾滋病(AIDS),则有关15C的叙述正确的是
| A.与C60中普通碳原子的化学性质不同 | B.与16O的中子数相同 |
| C.是C60的同素异形体 | D.与12C互为同位素 |
一化学兴趣小组在家中进行化学实验,按照左图连接好线路发现灯泡不亮,按照右图连接好线路发现灯泡亮,由此得出的结论正确的是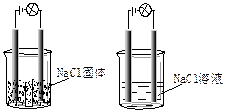
| A.NaCl固体中没有离子 | B. NaCl溶液是电解质 |
| C.NaCl在水溶液中电离出了可以自由移动的离子 | |
| D.NaCl溶液在电流作用下电离出大量的离子 |
下列实验操作中有错误的是
| A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| B.蒸馏时,温度计水银球应浸没在液体中 |
| C.蒸馏中,冷却水应从冷凝管的下口通入,上口流出。 |
| D.用湿润的红色石蕊试纸检验氨气 |
下列提纯方法不正确的是
| A.除去KNO3中的NaCl杂质-------结晶、重结晶 | B.除去食盐中的泥沙---溶解、过滤 |
| C.除去KCl中的K2CO3--------加适量硫酸 | D.除去碘水中的水-------用CCl4萃取 |
苹果汁是人们喜爱的饮料。由于饮料中含有Fe2+离子,现榨的苹果汁在空气中会由淡绿色变为棕黄色,即Fe2+转变为Fe3+离子。若榨苹果汁时加入维生素C,会可有效防止这种现象的发生。这说明维生素C具有:
| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
同温同压下,500 mL气体R的质量是1.2 g,1.5 L O2的质量是2.4 g,则R的相对分子质量为
| A.24 | B.36 | C.48 | D.60 |