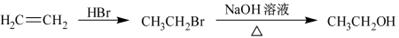下图是中学教材中元素周期表的一部分,其中标出A~Q14种元素,试回答下列问题:
(1)在上表所列出的短周期元素中(填具体物质化学式)原子半径最小的是(除稀有气体元素) ;阴离子还原性最弱的是 ;
最高价氧化物对应的水化物中酸性最强的是 。
(2)F和G两元素相比较,金属性较强的是 (填名称),可以验证该结论的实验是 。(填编号)
a.将在空气中放置已久的这两种元素的块状单质分别放入热水中
b.将这两种元素的单质粉末分别和同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
(3)Q在元素周期表中的位置是 ,B元素形成的单质的结构式为 。
(4)写出E的最高价氧化物对应的水化物与G单质发生的反应的离子方程式:
。
甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
(1)反应②是(填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系,如图所示。则平衡状态由A变到B时,平衡常数K(A)K(B)(填“>”、“<”或“=”)。据反应①与②可推导出K1、K2与K3之间的关系,则K3=(用K1、K2表示)。
(3)在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。
当曲线Ⅰ变为曲线Ⅱ时,改变的条件是。
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是。
(4)甲醇燃料电池有着广泛的用途,同时Al-AgO电池是应用广泛的鱼雷电池,其原理如图所示。该电池的负极反应式是。
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)= c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为。
已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A。其结构如右图:
(1)Cu元素基态原子的外围电子排布式为。
(2)元素C、N、O的第一电离能由大到小排列顺序为。
(3)A中碳原子的轨道杂化类型为。
(4)1mol氨基乙酸钠(H2N-CH2-COONa)含有σ键的数目为。
(5)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体:(写化学式)。
(6)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图,则该化合物的化学式是。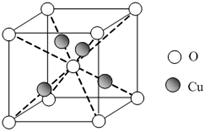
硫在地壳中主要以硫化物、硫酸盐等形式存在,其单质和化合物在工农业生产中有着重要的应用。
(1)已知:重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=" +" 571.2 kJ・mol—1
BaS(s)= Ba(s)+S(s)△H=" +460" kJ・mol—1
已知:2C(s)+O2(g)=2CO(g)△H=" -221" kJ・mol—1
则:Ba(s)+S(s)+2O2(g)=BaSO4(s)△H= 。
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料。已知As2S3和HNO3有如下反应:
As2S3+10H++ 10NO3-=2H3AsO4+3S+10NO2↑+ 2H2O
当反应中转移电子的数目为2mol时,生成H3AsO4的物质的量为。
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中主要含硫各物种(H2S、HS—、S2—)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。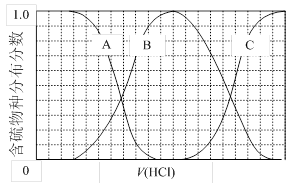
①含硫物种B表示。在滴加盐酸过程中,溶液中c(Na+)与含硫各物种浓度的大小关系为(填字母)。
a.c(Na+)= c(H2S)+c(HS—)+2c(S2—)
b.2c(Na+)=c(H2S)+c(HS—)+c(S2—)
c.c(Na+)=3[c(H2S)+c(HS—)+c(S2—)]
②NaHS溶液呈碱性,若向溶液中加入CuSO4溶液,恰好完全反应,所得溶液呈强酸性,其原因是(用离子方程式表示)。
(4)硫的有机物(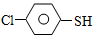 )与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O。
)与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O。 及X的核磁共振氢谱如下图,其中(填“Ⅰ”或“Ⅱ”)为
及X的核磁共振氢谱如下图,其中(填“Ⅰ”或“Ⅱ”)为 的核磁共振氢谱图。写出X的结构简式:。
的核磁共振氢谱图。写出X的结构简式:。
WO3可用于制备电阻元件、电子射线屏等。其工业生产流程如下: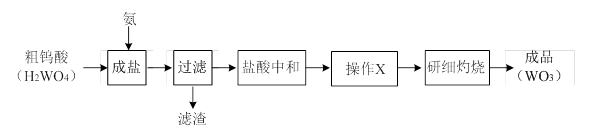
(1)操作X的目的是为了获得纯净的仲钨酸铵晶体,该操作包括:将用盐酸中和后的溶液、冷却结晶、、低温烘干。
(2)实际工业生产中,粗仲钨酸铵晶体(含少量NH4Cl晶体)可不经提纯就直接灼烧,其原因是。
(3)已知:仲钨酸铵晶体[x(NH4)2O·yWO3·zH2O]受热分解的化学方程式如下:
x(NH4)2O·yWO3·zH2O→WO3 +NH3↑+H2O↑(未配平)。
某同学为测定仲钨酸铵晶体的组成,进行如下实验:
①准确称取16.21g样品,研细灼烧;
②将产生的气体通入装有碱石灰干燥管,充分吸收称得干燥管增重1.44g;
③称量冷却后的固体质量为13.92g。
通过计算确定此仲钨酸铵晶体的化学式(写出计算过程)。
橙皮素具有抗氧化、消炎、降血脂、保护心血管和抗肿瘤等多种功效。它的合成路线如下: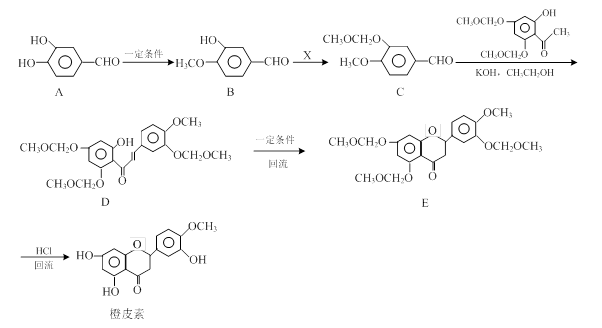
(1)化合物A中的含氧官能团有、(填官能团名称)。
(2)已知:B→C为取代反应,其另一产物为HCl,写出X 的结构简式:。
(3)反应D→E的反应类型是。
(4)写出同时满足下列条件的B的同分异构体的结构简式:。
Ⅰ.属于芳香族化合物;
Ⅱ.分子中有4种不同化学环境的氢;
Ⅲ.不能与FeCl3溶液发生显色反应,但能发生水解反应。
(5)已知:
结合流程信息,写出以对甲基苯酚和上述流程中的“X”为原料,制备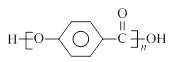 的合成路线流程图(无机试剂任用)。
的合成路线流程图(无机试剂任用)。
合成路线流程图示例如下: