(共9分)如图所示三套实验装置,分别回答下列问题。
(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入石墨棒的玻璃筒内滴入酚酞溶液,可观察到石墨棒附近的溶液变红,则该装置中石墨电极的反应式为_____________________________。
(2)装置2中的铜是______极(填“正”或“负”),该装置中石墨电极所发生的反应为_______________。
(3)装置3中甲烧杯盛放100 mL 0.2 mol·L-1的NaCl溶液,乙烧杯盛放100 mL 0.5 mol·L-1的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红。
①甲烧杯中铁为_____极;甲烧杯中石墨电极的电极反应式为____________________
②乙烧杯中电解反应的离子方程式为_________________________________________
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.64 g,甲烧杯中产生的气体在标准状况下的体积为________ mL 。
有机化学反应因反应条件不同,可生成不同的有机产品。例如:
(2)苯的同系物与卤素单质混合,若在光照条件下,侧链上氢原子被卤素原子取代;若在催化剂作用下,苯环上的氢原子被卤素原子取代。工业上利用上述信息,按下列路线合成结构简式为 的物质,该物质是一种香料。
的物质,该物质是一种香料。
请根据上述路线,回答下列问题:A可能的结构简式为 __________________________________。
反应③、⑤的反应类型分别为________、______。
反应④的化学方程式为(有机物写结构简式,并注明反应条件): ___________。
反应⑥的化学方程式为(有机物写结构简式,并注明反应条件): __________。
这种香料具有多种同分异构体,其中某些物质有下列特征:①其水溶液遇FeCl3溶液呈紫色②分子中有苯环,且苯环上的一溴代物有两种。③分子中有一个甲基,写出符合上述条件的物质可能的结构简式(写两种):,
某可逆反应从0—2分钟进行过程中, 在不同反应时间各物质的量的变化情况如图所示。则该反应的的反应物是,生成物是,化学方程式为;反应开始至2分钟时,能否用C表示反应速率?若能,其反应速率为 _____,若不能,则其原因为 _ ________________;2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了 ____状态。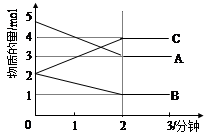
(12分)
已知A、B、C、D、E是短周期的5种元素,它们的原子序数依次增大。A元素原子形成的离子核外电子数为零;C、D、E三种元素的最高价氧化物对应水化物之间可以两两反应;A与C同主族;B与E同主族;E的单质为黄色晶体,易溶于二硫化碳。请写出B、D元素的名称:B,D
画出C元素的离子结构示意图
写出D的单质与C的最高价氧化物对应水化物之间反应的离子方程式
A、B、C三种元素形成的化合物为,所含的化学键类型为
(12分)下表为元素周期表的一部分,按要求完成各小题。
 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
| 2 |
⑥ |
⑦ |
⑾ |
|||||
| 3 |
① |
③ |
⑤ |
⑧ |
⑩ |
|||
| 4 |
② |
④ |
⑨ |
化学性质最不活泼的元素 (填元编号,下同),非金属性最强的元素是金属性最强的单质与水反应的离子方程式为
①③⑤三种元素的最高价氧化物水化物中,碱性最强的
①③⑤三种元素的原子半径由大到小的顺序为
某元素的最高价氧化物的水化物既能与酸反应生成盐和水又能与碱反应生成盐与水,该元素为 在两种盐中该元素的化合价为,该元素的最高价氧化物和盐酸反应的化学方程式为 向该元素和⑧号元素组成的化合物溶液中,缓缓滴加NaOH至过量,现象为
下面是你熟悉的物质:
①O2② 金刚石 ③ NaBr ④ H2SO4⑤ Na2CO3⑥ K2S⑦NaHSO4这些物质中,只含共价键的是_______________;只含离子键的是___________;既含共价键又含离子键的是_______________。
将NaHSO4溶于水,写出其电离方程式______________________________。