有A、B、C、D、E五种元素,A元素形成的-2价阴离子比氦的核外电子数多8个。B元素的一种氧化物为淡黄色固体,该固体遇到空气能生成A的单质。C为原子核内有12个中子的二价金属,当2.4 g C与足量盐酸反应时,生成标准状况下的H2 2.24 L。D的原子M层上有7个电子,E与A同周期且最外层比次外层多3个电子。
(1)C离子的结构示意图 。
(2)A、E氢化物的稳定性比较 。(填化学式)
(3)A、B、C、D四种离子半径由大到小顺序 (用离子符号表示)。
(4)用电子式表示C与D形成化合物的形成过程:
。
(5)写出D单质与B的最高价氧化物对应水化物反应的离子方程式:
。
(6)写出Cu与E的最高价氧化物对应水化物稀溶液反应的离子方程式:
。
Mg及其化合物可以发生如下转化(部分反应物、生成物或水已略去),已知X、Y、Z为气态单质,B常温下为液态,化合物D的焰色反应为黄色,C和G混合冒白烟并生成A,电解E的水溶液常用于某种工业生产。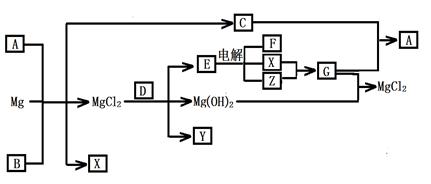
(1)写出下列物质的化学式
AY
(2)写出C的电子式
(3)写出MgCl2与D反应的化学方程式
(4)请用水解平衡理论解释A+B+Mg→C+X+ MgCl2的原因_______________________。
(5)将0.1molCO2通入1L溶质为F的溶液中,充分反应后,再向混合液中逐滴滴加盐酸,所加盐酸的体积与生成的气体的 关系如下图所示:则原F溶液的浓度为mol/L。
关系如下图所示:则原F溶液的浓度为mol/L。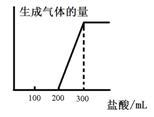
有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A的原子半径最小,B与A能以原子个数1:1、1:2或1:3等组成多种常见化合物;C的最高正价和最低负价的代数和为2;D与F位于同一主族;E与D能以原子个数1:1或2:1形成两种常见化合物.
(1)A与B能形成一种最简单的直线型分子,其电子式为。
(2) CA3极易溶于液态A2D中,其原因 是。
是。
(3)将标准状况下的4.48 L CA3完全溶解在含0.1mol HCl的水溶液中得1L溶液,所得溶液pH=9,其中离子浓度由大到小的顺序是。
(4)物质B2A6D在电解质EDA 的溶液作用下,可形成燃料电池,则该电池的负极反应式为。
的溶液作用下,可形成燃料电池,则该电池的负极反应式为。
(5)E与F形成的化合物属于型化合物(填:离子或共价),用惰性电极电解该化合物的水溶液时,有固体析出,则电解总反应方程式为。
计算题:
已知:晶体“二氧化硅”可由晶体“硅”衍生得到;下图是晶体“硅”及“二氧化硅”的晶胞示意图:
试回答:
(1)请写出SiO2晶体的两种主要用途:
(2)请写出与晶体SiO2化学键及晶体类型完全相同的两种物质的名称:
(3)已知:二氧化硅晶体的密度为ρg/cm3 , 试求二氧化硅晶体中最近的两个Si原子之间的距离的表达式?(保留原表达式,不用化简)
有A、B、C、D、E、F、G七种元素,除E为第四周期元素外其余均为短周期元素。A、E、G位于元素周期表的s区,其余元素位于p区。A、E的原子外围电子层排布相同,A的原子中没有成对电子;B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同;C元素原子的外围电子层排布式为nsnnpn+1;D元素形成的一种单质为淡黄色,不溶于水、微溶于酒精、易溶于CS2;F的基态原子核外成对电子数是成单电子数的3倍;G原子有三个电子层,其基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数相同。回答下列问题:
(1)写出下列元素的符号:D,G;(每空2分)
(2)写出基态C原子的轨道表示式:
(3)由A、B、C形成的ABC分子中,含有个σ键,个π键;(每空2分)
(4)由D、E、F、G形成的盐E2DF4、GDF4的共熔体在冷却时首先析出的物质是:(写化学式),原因是;(每空2分)
已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的。D原子得到一个电子后3p轨道全充满。A+比D原子形成的离子少一个电子层。C与A形成A2C型离子化合物。E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C、D的第一电离能由小到大的顺序为____________________________。
(2)C的氢化物分子是(填“极性”或“非极性”)分子。
(3)化合物BD3的分子空间构型是。
(4)E的一种常见配合物E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非
极性溶剂。据此可判断E(CO)5的晶体类型为;E(CO)5在一定条件下发生分解反应:E (CO)5 ="=" E (s) + 5CO,反应过程中,断裂的化学键只有配位键,形成的化学键是。
(5)金属E单质的晶体在不同温度下有两种堆积方式,晶胞如图所示。
则: 体心立方晶胞和面心立方晶胞的棱长之比为:。(保留比例式,不要求计算结果)