(14分)下表是元素周期表的短周期部分,表中字母分别表示一种元素。请回答下列问题:
| a |
|
|
|||||
| |
|
|
b |
c |
d |
|
|
| e |
|
f |
|
|
g |
|
|
(1) f元素在周期表中的位置是第 周期第 族。
(2) e 与f两元素最高价氧化物的水化物相互反应的化学方程式为
_________________________________________________
(3)e在空气中燃烧的产物所含化学键的类型为__________、__________。
(4) 化合物ca3的电子式为 ,c和d两种元素氢化物的稳定性更强的是 _______(填物质的化学式)。
如图所示装置:
①若烧杯中溶液为稀硫酸,
电极反应式为:正极;
负极。
②若烧杯中溶液为氢氧化钠溶液,则负极为,
总反应方程为。
某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。
①由图中所给数据进行分析,该反应的化学方程式为;
②反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=,
③当反应进行了3 min,该反应是否达到平衡(填“是”或“否”)。
(2)把除去氧化膜的镁条投入到盛有稀盐酸的试管中,发现H2生成的速率变化情况如图,其中
T1~T2速率变化的主要原因是____,
T2~T3速率变化的主要原因是___ ___
(13分)下表列出了A—R9种元素在周期表中的位置,用元素符号或化学式填空。
 主族周期 主族周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
E |
F |
||||||
| 3 |
A |
C |
D |
G |
R |
|||
| 4 |
B |
H |
(1)这九种元素中:化学性质最不活泼的是;金属性最强的是:最高价氧化物的水化物碱性最强的碱的电子式是最高价氧化物的水化物酸性最强的酸是;
(2)D元素的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是
。
(3 )A、B、C三种元素按原子半径由大到小的顺序排列的为。
(4)F的氢化物的电子式;G、H 氢化物的稳定性递减的顺序是:。
(5)H元素跟A元素形成的化合物的电子式是。
(6 ) C和G两种元素形成的化合物属于(填“离子化合物”或“共价化合物”),请用电子式表示其形成过程。
(2分)已知乳酸的结构简式为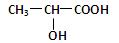 。试回答:
。试回答:
乳酸分子中含有________和_________两种官能团(写名称);
(5分) 某有机物气体含碳82.7%,含氢17.3%,在标准状况下它的密度是2.59g/L。则(1)此有机物的相对分子质量为____________;(2)此有机物的分子式为____________;其可能的结构简式为