某化学兴趣小组设计实验制取乙酸乙酯。现用下图装置进行实验,在圆底烧瓶内加入碎瓷片,再加入由2 mL 98%的浓H2SO4和3 mL乙醇组成的混合液,通过分液漏斗向烧瓶内加入2 mL 冰醋酸,烧杯中加入饱和Na2CO3溶液。请回答下列问题:
(1)写出圆底烧瓶内发生反应的化学方程式: ;
反应中加入浓硫酸的作用是 ;
(2)球形干燥管C的作用是 ;
(3)反应结束后D中的现象是 ;
分离出D中的乙酸乙酯时需要的玻璃仪器是_ 。
中和热的测定是高中重要的定量实验。取0.55 的NaOH溶液50mL与0.50
的NaOH溶液50mL与0.50 的盐酸50mL置于右图所示的装置中进行中和热的测定实验,回答下列问题:
的盐酸50mL置于右图所示的装置中进行中和热的测定实验,回答下列问题:
(1)从右图实验装置看,其中尚缺少的一种玻璃用品是____________,除此之外,装置中的一个明显错误是。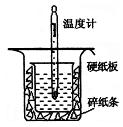
(2)右图中的小烧杯应该选择下列哪种规格的。(选填代号)
①50 mL ②100 mL ③150 mL ④250 mL
(3)为了便于计算,假定混合前后溶液的密度都近似为1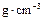 ,假定反应后生成溶液的比热容近似为水的比热容
,假定反应后生成溶液的比热容近似为水的比热容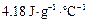 ,用t1℃和t2℃代表反应前后溶液的温度,则该实验中和热的计算表达式为
,用t1℃和t2℃代表反应前后溶液的温度,则该实验中和热的计算表达式为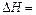 。
。
某校化学学习小组拟验证NO能被氨气还原并测定其转化率,设计如下实验:
参考知识:NO气体与FeSO4溶液反应生成可溶性硫酸亚硝基合铁(Ⅱ):NO+FeSO4=Fe(NO)SO4
试回答下列问题:
⑴实验室用氯化铵与氢氧化钙固体制备氨气,应选用的装置是
该反应的化学方程式
实验室通常用法收集氨气,检验该气体是否收集满方法
⑵装置③、④若用同一装置,则该装置中所盛装的药品是
| A.Na2O2 | B.浓硫酸 | C.P2O5 | D.碱石灰 |
⑶装置⑥中,粗玻璃管X的作用,装置⑦的作用
⑷装置⑥的广口瓶中,除生成Fe(NO)SO4外,还有白色沉淀生成,写出生成该沉淀的离子方程式
⑸若参加反应的NO为2.688L(标准状况,下同),氨气过量,最后收集到2.016LN2,则装置⑤中NO的转化率为
小明为验证NO2的氧化性和NO的还原性,设计了如下装置制取NO 2和NO,并验证其性质,装置图如下:
2和NO,并验证其性质,装置图如下:
⑴写出甲中反应的离子方程式: ______________________;乙中的现象是____________,可证明NO2的氧化性;在丙中鼓入空气后现象是__________,可证明NO的还原性。
⑵实验前丙中充满水的作用是____________________________________________(用反应方程式和简要文字回 答)。
答)。
⑶小华对小明的实验设计提出了质疑,他认为乙中的现象不足以证明NO2的氧化性,他的理由是__________________________________。你认为怎样才能准确证明NO2的氧化性?______________________________________________________(简要回答出原理和现象即可)
某矿抽出的废液中含有大量的K+、Cl-、Br-,还有少量的Ca2+、Mg2+、SO42-。某研究性学习小组拟用这种废液来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程:
可供试剂a、b的选择试剂:饱和Na2CO3溶液、饱和K2CO3溶液、KO H溶液、BaCl2溶液、Ba(NO3)2溶液、H2O2、KMnO4(H+)溶液、稀HNO3。
H溶液、BaCl2溶液、Ba(NO3)2溶液、H2O2、KMnO4(H+)溶液、稀HNO3。
请根据以上流程,回答相关问题:
⑴试剂a应该选用_______________;
⑵操作①、②、③、④、⑤的名称是_________(填字母)。
| A.萃取、过滤、分液、过滤、蒸发结晶 | B.萃取、分液、蒸馏、过滤、蒸发结晶 |
| C.分液、萃取、过滤、过滤、蒸发结晶 | D.萃取、分液、分液、过滤、蒸发结晶 |
⑶欲除去无色液体I中的Ca2+、Mg2+、SO42-离子,选出b所代表的试剂,按滴加顺序依次是(填化学式)。
⑷调节pH 的作用是,操作方法是。
的作用是,操作方法是。
⑸操作⑤中用到的瓷质仪器名称是。
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入 ,目的是 。
(2)反应中加入过量的乙醇,目的是 。
(3)如果将上述实验步骤改为在蒸馏烧瓶内先加入乙醇和浓硫酸,配制乙醇、浓硫酸混合液的操作方法是 。
(4)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物下列框图是分离操作步骤流程图如下:
则试剂a是: ,分离方法I是 ,分离方法II是 ,
试剂b是 ,分离方法III是 。
(5)甲、乙两位同学欲将所得含有乙醇、乙酯和水的乙酸乙酯粗产品提纯,在未用指示剂的情况下,他们都是先加NaOH溶液中和酯中过量的酸,然后用蒸馏法将酯分离 出来。甲、乙两人实验结果如下,并回答问题,
出来。甲、乙两人实验结果如下,并回答问题,
甲得到了显酸性的酯的混合物;乙得到了大量水溶性的物质;丙同学分析了上述实验目标产物后认为上述实验没有成功。
①甲实验失败的原因是: ②乙实验失败的原因是:
②乙实验失败的原因是: