为探究一溴环己烷( 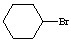 )与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
)与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
甲:向反应混合液中滴入稀硝酸中和NaOH,然后再滴入AgNO3溶液,若有浅黄色沉淀生成则可证明发生了消去反应。
乙:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应。
丙:向反应混合液中滴入酸性KMnO4溶液,若溶液颜色变浅,则可证明发生了消去反应。
其中正确的是( )
| A.甲 | B.乙 | C.丙 | D.上述实验方案都不正确 |
下列实验操作正确的是
| A.检验某溶液中是否含有甲醛:在盛有2mL10%硫酸铜溶液的试管中,滴加4~8滴10%的氢氧化钠溶液,混合均匀,滴入待检液,加热 |
| B.实验室制乙烯:将浓硫酸与无水乙醇按体积比3∶1混合后迅速加热至170℃ |
| C.制取溴苯:将铁屑、液溴、苯充分混合后加热 |
| D.提取溶解在水中的少量碘:加入植物油振荡、静置、分层后取出有机层再分离 |
洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如下图所示,有关洋蓟素的说法正确的是
| A.1mol洋蓟素最多可与11mol H2反应 |
| B.不能与氯化铁溶液发生显色反应 |
| C.一定条件下能发生酯化反应和消去反应 |
| D.1mol洋蓟素最多可与5mol NaOH反应 |
用NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.标准状况下,22.4L甲醇中含有的氧原子数为1.0NA |
| B.25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA |
C.标准状况下,2.24L Cl2与足量的稀NaOH 溶液反应 ,转移电子总数为0.2NA ,转移电子总数为0.2NA |
| D.常温常压下,46g NO2 与N2O4的混合气体中含有的原子总数为3NA |
下列有关实验的现象描述正确的是
| A.氢气在氯气中燃烧,火焰呈苍白色,产生大量白雾 |
| B.硫在空气中燃烧,发出明亮的蓝紫色火焰,产生有刺激性气味的气体 |
| C.铜在氯气中燃烧,产生白烟,加水溶解后可能得到绿色溶液 |
D.用洁净的玻璃棒蘸取碳酸钾粉 末在酒精灯火焰上灼烧,可观察到明亮的紫色火焰 末在酒精灯火焰上灼烧,可观察到明亮的紫色火焰 |
下列有关化学用语正确的是
A.碳原子的轨道表示式: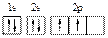 |
B.次氯酸分子的电子式: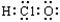 |
C.CH4Si的结构式: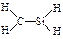 |
D.质量数为137的钡原子: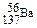 |