如下图,利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水(此法可快速制备氨气),立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是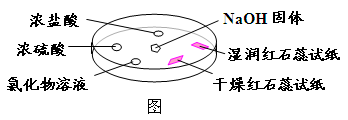
| 选项 |
实验现象 |
解释 |
| A |
浓盐酸附近产生白烟 |
NH3与浓盐酸反应产生了NH4Cl固体 |
| B |
浓硫酸附近无明显现象 |
NH3与浓硫酸不发生反应 |
| C |
氯化物溶液变浑浊 |
该溶液一定是AlCl3溶液 |
| D |
干燥红石蕊试纸不变色,湿润红色石蕊试纸变蓝 |
NH3是一种可溶性碱 |
下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是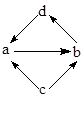
| 编号 |
a |
b |
c |
d |
| A |
Na2O |
Na2O2 |
Na |
NaOH |
| B |
NaAlO2 |
Al2O3 |
Al |
Al(OH)3 |
| C |
FeCl2 |
FeC13 |
Fe |
CuCl2 |
| D |
NaOH |
NaHCO3 |
Na2CO3 |
CO2 |
用NA表示阿伏加德罗常数的值,下列说法正确的是
| A.标准状况下,22. 4 L H2O含有的分子数为NA |
| B.2.7g铝与足量氢氧化钠溶液反应转移的电子数NA |
C.0.5 mol/LFe2(SO4)3 溶液中,SO 的数目为1.5NA 的数目为1.5NA |
| D.常温常压下,48 g O2和O3的混合物中含有的氧原子数为3NA |
下列关于某些物质(离子)的检验方法或结论正确的是
| A.向FeCl3溶液中滴人KSCN溶液,产生血红色沉淀 |
| B.利用丁达尔效应鉴别淀粉溶液和NaCl溶液 |
| C.向某溶液中加入BaCl2溶液出现白色沉淀,则该溶液中肯定有SO42- |
| D.用焰色反应可鉴别出NaCl、KCl和Na2SO4三种物质 |
下列各组中的离子,能在溶液中大量共存的是
| A.Mg2+ 、Na+、CO32-、Cl- | B.Ag+、Al3+、NO3-、H+ |
| C.Fe2+、H+、SO42-、NO3- | D.Ba2+、Na+、Cl-、SO42- |
下列反应的离子方程式正确的是
| A.硫酸与氢氧化钡溶液反应:H++OH—=H2O |
| B.用FeCl3腐蚀Cu制作印刷电路板:2Fe3++Cu=2Fe2++Cu2+ |
| C.向氯化铝溶液中加入过量的氨水:Al3++4OH-=AlO2—+2H2O |
| D.金属钠跟水反应 Na+2H2O = Na++2OH-+H2↑ |