硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1 将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。
步骤2 向处理过的铁屑中加入过量的3mol·L-1 H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3 向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)在步骤1的操作中,下列仪器中不必用到的有__________(填仪器编号)
①铁架台 ②燃烧匙 ③锥形瓶 ④广口瓶 ⑤研钵 ⑥玻璃棒 ⑦酒精灯
(2)在步骤2中趁热过滤,其原因是________________________________;
(3)在步骤3制的的硫酸亚铁铵晶体常含有Fe3+杂质。检验Fe3+的试剂可以用K4〔Fe(CN)6〕生成普鲁士蓝沉淀,有关的离子方程式是_________________________ _____。
(4)制得的晶体经过过滤后用无水乙醇洗涤而不用蒸馏水,理由是__________________;(任说两点)
(5)在25℃时,相同物质的量浓度的(NH4)2CO3、(NH4)2SO4、硫酸亚铁铵三种盐溶液a、b、c,其铵根离子浓度由小到大的排列顺序为_______________(用a、b、c回答)
实验室配制480 mL 0.1 mol·L-1Na2CO3溶液,完成下列问题:
(1)应用托盘天平称取无水碳酸钠粉末__________g。
(2)若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上,天平平衡时,则实际称量的碳酸钠粉末是__________g(1 g以下用游码)。
(3)配制Na2CO3溶液时需用的主要仪器有__________、__________、__________、__________、__________。
(4)使用容量瓶配制溶液时,下列情况会使所配溶液浓度偏低的是__________。
①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了②无水碳酸钠粉末已部分吸水变成晶体③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤④转移溶液前容量瓶内有少量蒸馏水⑤定容时,俯视容量瓶的刻度线⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
Ca3(PO4)2、CaHPO4均为难溶于水的白色固体。某同学向Na2HPO4溶液中滴加CaCl2溶液至恰好反应,生成了白色沉淀。试设计一个简单的实验方案,来证明所生成的白色沉淀是Ca3(PO4)2还是CaHPO4。
实验原理:______________________________
实验用品及试剂:试管、胶头滴管、_______________________________
实验步骤、现象、结论(可不填满)
①_________________________________;②_______________________________;
③_________________________________;④_______________________________。
设计实验证明盐酸和NaOH溶液发生了反应。学生提出了许多有创意的想法:①用酸碱指示剂监测,②用pH试纸监测,③利用导电实验测定离子浓度的变化,④将盐酸和碱液混合后的溶液蒸干后品尝味道。请对上述创意作出评判后回答下列问题:
⑴在想法①中,如果是将NaOH溶液滴入盐酸中,可以在盐酸中先加几滴____(填一种酸碱指示剂的名称),再不断滴入NaOH溶液,颜色由___变_____。
⑵在想法②中,写出测定pH的基本操作:____________________。
⑶在想法③中,如用浓度均为1mol/L的盐酸和NaOH溶液进行实验,简述实验的操作步骤,并说明是如何判断盐酸与NaOH溶液发生了反应。
⑷对第④中设计,提出你的看法?
⑸你能否提出其它一些有创意的想法。
设计一个实验,能通过观察到明显的现象,说明CO2与NaOH溶液发生了反应。实验用品:集气瓶、烧瓶、分液漏斗、长颈漏斗、导管、橡皮管、弹簧夹、烧杯、量筒、水、CO2气体、NaOH溶液以及你认为所能用到的仪器和药品。现有五位学生装设计了如图所示五个装置,试回答:
(A)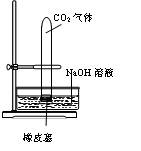 (B)
(B)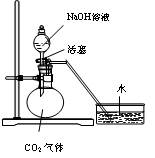
(C)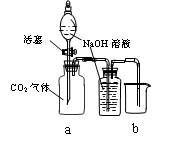 (D)
(D)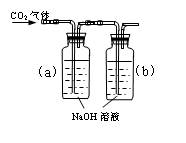
(E)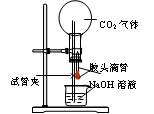
⑴对图A-E,请指出能达到实验目的的装置_______(用A、B、C、D、E填空),并说明能证明CO2与NaOH溶液发生了反应的操作及实验现象,将结果填入下表:
| 装置 |
实验方法 |
实验现象 |
⑵能否设计出其它一些方法来证明CO2与NaOH溶液发生了反应。
新装修的居室内,甲醛浓度往往很大.严重污染空气.居住者接触时间较长易得白血病。1×10—5mol·L—1的紫色KMnO4溶液遇甲醛气体即褪色。用下面的微型化学实验可测定室内空气甲醛含量:
(1) 试设计实验,在中学实验室里配制100mL l.00×10-4mol·L-1KMnO4溶液;
(2) 用2.5mL注射器准确量取2mL l.00×10—4mol·L—1KMnO4溶液,注入六孔穴板1*孔内,加入3滴6 mol·L—1H2SO4溶液,盖好塞子;按图连接好装置。将此装置置于待测地点,缓慢抽气,每次抽气50mL,直到溶液红色褪去,记录抽气次数。已知有关反应为:5HCHO+4KMnO4+6H2SO4 5CO2+11H2O+2K2SO4+4MnSO4
5CO2+11H2O+2K2SO4+4MnSO4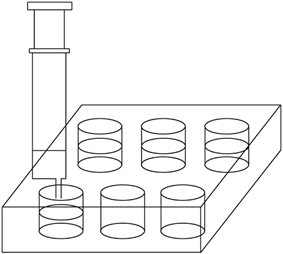
(3) 设抽气次数为n,试计算甲醛在空气中的含量(mg/m3)。
(4) 若室内空气中甲醛气体最高允许浓度为20mg·m-3试分析讨论室内空气符合标准时n的取值范围。
(5) 为保证实验结果精确性,实验过程中应注意什么?