工业制硫酸中的一步重要反应是SO2在400~500℃下的催化氧化:
2SO2+O2 2SO3,这是一个放热的可逆反应。如果反应在密闭容器中进行,下列有关说法中,错误的是( )
2SO3,这是一个放热的可逆反应。如果反应在密闭容器中进行,下列有关说法中,错误的是( )
| A.在上述条件下,SO2不可能100%地转化为SO3 |
| B.达到平衡时,单位时间生成2a mol SO3,同时生成a mol O2 |
| C.为了提高SO2的转化率,应适当提高O2的浓度 |
| D.达到平衡时,SO2的浓度与SO3的浓度相等 |
下列化学用语正确的是
| A.乙醇的结构筒式:C2H6O |
B.CH4的比例模型: |
C.工业上制取粗硅的化学方程式:SiO2+C Si+CO2↑ Si+CO2↑ |
| D.电解饱和食盐水的离子方程式:Cl-+2H2O=Cl2↑+2OH-+H2↑ |
化学与生产、生活及环境密切相关,下列说法正确的是
| A.CO2、NO2或SO2都会导致酸雨的形成 |
| B.利用丁达尔效应可区别蛋白质溶液和氢氧化铝胶体 |
| C.煤经过气化和液化等物理变化后可以转化为纯净物 |
| D.新型氢动力计程车的投入使用有益于减少雾霾的产生 |
在稀硫酸与锌反应制取氢气的实验中,探究加人硫酸铜溶液的量对氢气生成速率的影响。实验中Zn粒过量且颗粒大小相同,饱和硫酸铜溶液用量0一4.0mL,保持溶液总体积为100.0mL,记录获得相同体积(336 mL,)的气体所需时间,实验结果如图所示(气体体积均转化为标况下)。据图分析,下列说法不正确的是
| A.饱和硫酸铜溶液用量过多不利于更快收集氢气 |
| B.a ,c两点对应的氢气生成速率相等 |
| C.b点对应的反应速率为v( H2SO4)=1.0x10-3mol·L -1 ·s-1 |
| D.d点没有构成原电池,反应速率减慢 |
粒子甲与粒子乙在溶液中的转化关系如下图所示,粒子甲不可能是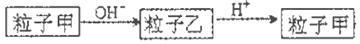
| A.NH4+ | B.Al | C.HCO3一 | D.SO2 |
对100mL 1mol·L-1的Na2CO3溶液,下列说法不正确的是
A.将溶液稀释,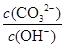 减少 减少 |
| B.滴人含0.l mol CH3COOH的溶液:c ( CH3 COO一)<c( HCO3一) |
| C.通人0.1 mo1CO2气体,溶液中存在:c ( Na+)=c( CO32一)十c( HCO3一)+c(H2CO3) |
| D.滴人酚酞,微热,溶液颜色加深 |