下列化学方程式或离子方程式中,正确的是
| A.向氢氧化钠溶液中通入少量CO2: CO2+NaOH ══ NaHCO3 |
| B.FeCl3溶液与Cu反应的离子方程式: Fe3++Cu ══ Cu2++Fe 2+ |
| C.铜与浓硝酸:Cu+4HNO3(浓)══ Cu(NO3)2+ 2NO↑+ 2H2O |
| D.向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至刚好沉淀完全离子方程式:NH4++H++SO42-+ Ba2++2OH-══ BaSO4↓+ NH3·H2O+ H2O |
下列有机反应中,与其它三个反应类型不同的是 ()
A. |
B.2CH3CH2OH+O2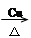 2CH3CHO+2H2O 2CH3CHO+2H2O |
| C.2C2H5OH →C2H5–O–C2H5+H2O |
D.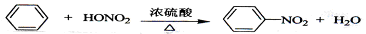 |
已知乙烯、乙酸与乙酸乙酯的混合物中含氢的质量分数为7%, 则含O的质量分数是 ( )
| A.42% | B.44% | C.51% | D.91.9% |
下列说法正确的是()
| A.某有机物燃烧只生成CO2和H2O,且二者的物质的量相等,则此有机物的组成为CnH2n |
| B.相同质量的烃,完全燃烧,烃中碳的百分含量越高,消耗O2越少 |
| C.某气态 CxH4若与足量O2完全反应,则反应前后气体体积不变 |
| D.烃在足量的氧气中燃烧并通过浓H2SO4,减少的体积就是生成的水蒸气的体积 |
下列实验操作和结论错误的是( )
| A.用新制Cu(OH)2悬浊液可鉴别麦芽糖和蔗糖 |
| B.用银镜反应可证明蔗糖是否转化为葡萄糖,但不能证明是否完全转化 |
| C.浓H2SO4可使蔗糖变黑,证明浓H2SO4具有脱水性 |
| D.蔗糖溶液中滴加几滴稀H2SO4,水浴加热几分钟,加入到银氨溶液中,不能发生银镜反应,证明蔗糖不水解 |
如图所示,N4分子结构与白磷分子相似,呈正四面体结构。已知断裂1molN—N键吸收193kJ热量,断裂1molN≡N键吸收941kJ热量,则下列说法正确的是()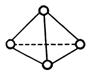
| A.N4是一种含非极性共价键的新型化合物 |
| B.1mol N4气体转化为N2时要放出724kJ能量 |
| C.N4是氮气的一种同位素 |
| D.N4的结构比N2更对称,因此N4比N2更稳定 |