诺龙属于国际奥委会明确规定的违禁药物中的合成代谢类类固醇,其结构简式如图所示。下列关于诺龙性质的说法中不正确的是( )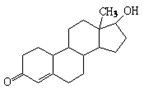
| A.能与氢气反应 | B.能与金属钠反应 |
| C.能与NaOH溶液反应 | D.不能与新制Cu(OH)2悬浊液反应 |
下列关于铜电极的叙述正确的是
| A.铜锌原电池中铜是正极 |
| B.用电解法精炼精铜时粗铜作阴极 |
| C.在镀件上电镀铜时可用金属铜作阴极 |
| D.电解稀硫酸制H2、O2时铜作阳极 |
“暖宝宝”取暖片的材料中含有铁粉、水、活性炭、硅石、食盐等,它们组成一个原电池,在反应时释放出热量,铁粉在原电池中充当
| A.负极 | B.正极 | C.阴极 | D.阳极 |
把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连可以组成几个原电池。若a、b 相连时a为负极;c、d相连时电流由d到c;a、c相连时c极上产生大量气泡;b、d相连时b上有大量气泡产生,则四种金属的活动性顺序由强到弱为
| A.a>b>c>d | B.a>c>d>b |
| C.c>a>b>d | D.b>d>c>a |
为了降低某水库的铁闸门被腐蚀的速率,可以采取如图所示的方案,其中焊接在铁闸门上的固体材料R可以采用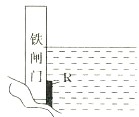
| A.铜 | B.钠 | C.锌 | D.石墨 |
在钢铁腐蚀过程中,下列五种变化可能发生的是①Fe2+转化为Fe3+、②O2被还原、③产生H2、④Fe(OH)3失水形成Fe2O3·xH2O、⑤杂质碳被氧化
| A.①② | B.②③④ | C.①②③④ | D.①②③④⑤ |