一定条件下,对于反应N2+3H2  2NH3来说,下列反应速率中最快的是( )
2NH3来说,下列反应速率中最快的是( )
| A.V(H2)=0.6mol/(L·min) | B.V(NH3)="0.5" mol/(L·min) |
| C.V(H2)="0.01" mol/(L·s) | D.V(N2)="0.3" mol/(L·min) |
丙酮是一种有机溶剂,可与水以任意体积比互溶,密度小于1 g/mL,沸点约55 oC,分离水和丙酮时最合理的方法是( )
| A.蒸发 | B.分液 | C.过滤 | D.蒸馏 |
在标准状况下,将VLA气体(摩尔质量为Mg·mol-1)溶于0.1L水中,所得溶液的密度为ρg·cm-3,则此溶液的物质的量浓度(mol·L-1)为()
A.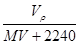 |
B. |
C.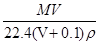 |
D.1000VρM(MV+2240) |
下列各组离子能够在指定的环境下大量共存的是()
| A.在pH=0的溶液中:Na+、K+、MnO4-、Cl- |
| B.和Al反应能产生氢气的溶液:K+、NH4+、Cl-、S2O32- |
| C.中性溶液:Al3+、K+、SO42-、AlO2- |
| D.c(H+)<c(OH-)的溶液:Na+、K+、SO32-、S2- |
在物质的量浓度均为0.01 mol/L的CH3COOH和CH3COONa混合溶液中,测得c(CH3COO-)>c(Na+),则下列关系式正确的是 ()
A.c(H+)>c(OH)
B.c(CH3COOH)+c(CH3CO-)》0.02 mol/L
Cc(OH-)>.c(H+)
D.c(CH3COOH)>c(CH3COO-)
将FeCl3溶液蒸干灼烧,最后得到固体产物是()
| A.无水FeCl3 | B.Fe(OH)3 | C.FeO | D.Fe2O3 |