下图中A~J均为中学化学中常见的物质,它们之间有如下转化关系。其中A、D为常见金属单质,B、C为金属氧化物,H为白色沉淀,I为红褐色沉淀。(反应过程中生成的水及其他产物已略去)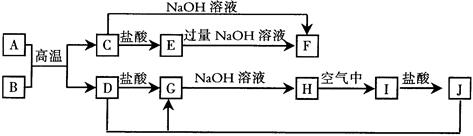
请回答以下问题:
(1)A在元素周期表中的位置是 ;在大规模工业生产中,用B冶炼
D所使用的还原剂是 。
(2)写出反应“J+D→G”的离子方程式: ;实验室也可以将G直接转化为J,所用的试剂为 。
(3)C与NaOH溶液反应、E与过量的NaOH溶液反应,其产物之一都含A元素,该
产物中A元素的存在形式为 (用化学符号表示)。
组蛋白去乙酰化酶(HDAC)抑制剂能激活抑癌基因,从而抑制肿瘤细胞生长,诱导肿瘤细胞凋亡。下面是一种HDAC抑制剂(F)的合成路线: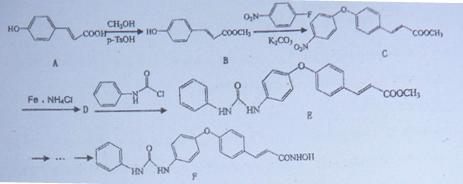
已知①同一个碳 原子上连接2个羟基的结构不稳定,会失去一个分子
原子上连接2个羟基的结构不稳定,会失去一个分子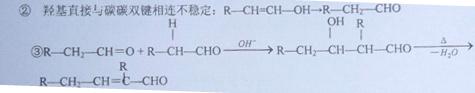
(1)写出A转化为B的化学方程式。
(2)写出E中2种含氧官能团的名称。
(3)B到C的转化过程中,还生成一种小分子,其分子式为。
(4)写出D的结构简式。
(5)写出符合下列条件的B的同分异构体的结构简式。
a.苯环上有3个互为间位的取代基,且有一个为甲基;
b.能与FeCl3溶液发生显色反应;
c.不能发生银镜反应,但水解产物能发生银镜反应。
(6)写出以对甲基苯酚(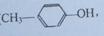 )和乙炔为主要原料制备化合物A的合成路线流程图(
)和乙炔为主要原料制备化合物A的合成路线流程图( 无机试剂任选)。合成路线流程图示例如下:
无机试剂任选)。合成路线流程图示例如下: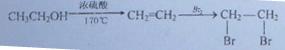
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
已知:①NiCl2易溶于水;Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O
③某温度下一些金属氢氧化物的KSP及沉淀析出的理论pH如下表所示:
| M(OH)n |
KSP |
开始沉淀时pH |
沉淀完全时的pH |
| Al(OH)3 |
1.9×10-23 |
3.4 |
4.2 |
| Fe(OH)3 |
3.8×10-38 |
2.5 |
2.9 |
| Ni(OH)2 |
1.6×10-14 |
7.6 |
9.8 |
回答下列问题:
(1)用NiO调节溶液的pH,依次析了沉淀I沉淀Ⅱ(填化学式)。
(2)写出加入Na2C2O4溶液的反应的化学方程式:。
(3)检验电解溶液时阳极产生的气体的方法:。
(4)写出“氧化”反应的离子方程式:。
(5)如何检验Ni(OH)3已洗涤干净?。
硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2(约45%)、Fe2O3(约40%)、Al2O3(约10%)和MgO(约5%)。某同学设计了如下方案,分离样品中各种金属元素。请回答下列问题。
(1)写出溶液B的溶质是。
(2)参照以下框的形式进一步完成“溶液C”到“Al2O3”的流程(注明试剂、条件和操作)。
(3)为了分析某硫酸渣中铁元素的含量,先将硫酸渣预处理,把铁元素还原成 Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定。
①判断到达滴定终点的现象是。
②某同学称取2.000g硫酸渣,预处理后在容量瓶中配制成100mL溶液,移到25.00mL试样溶液,用0.0050mol·L-1KMnO4标准溶液滴定,达到滴定终点时,消耗标准溶液20.00mL,则残留物中铁元素的质量分数是。
CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图:
已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
7.6 |
3.4 |
| 完全沉淀 |
4.1 |
9.7 |
9.2 |
5.2 |
请回答下列问题:
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为
 。
。
(2)加入碳酸钠调节pH至a,a的范围是;
(3)操作Ⅰ包含3个基本实验操作,它们是、和过滤。
(4)制得的CoCl2·6H2O需减压烘干的原因是 。
(5)为测定产品中CoCl2·6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是(任写1点)。
(12分)
随着氮氧化物污染的日趋严重,国家将于“十二五”期间加大对氮氧化物排放的控制力度。目前,用活性炭还原法处理氮氧化物是消除氮氧化物污染的有效方法。
⑴已知产物 A、B 都是参与大气循环的气体,请结合下表数据写出NO与活性炭反应的化学方程式:
⑵某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
 浓度/mol·L-1 浓度/mol·L-1
时间/min |
NO |
A |
B |
||||
| 0 |
0. 10 |
0 |
0 |
||||
| 10 |
0.058 |
0.021 |
0.021 |
||||
| 20 |
0.040 |
0.030 |
0.030 |
||||
| 30 |
0.040 |
0.030 |
0.030 |
||||
| 40 |
0.032 |
0. 034 |
0.017 |
||||
| 50 |
0.032 |
0. 034 |
0.017 |
①T1℃时,求该反应平衡常数(列出K的表达式,要求计算过程)。
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 。
③若30min后升高温度至T2℃,达到平衡时,容器中NO、A、B的浓度之比为5:3:3,则该 反应的△H 0(填“>”、“=”或“<”)。
反应的△H 0(填“>”、“=”或“<”)。
④压缩容器体积,增大压强对该反应的反应速率和平衡移动的影响是 。