下表列出了断裂某些化学键所需的能量:
| 化学键 |
H—H |
Cl-Cl |
I—I |
O=O |
O—H |
H-Cl |
H—I |
| 断裂1 mol化学键所吸收的能量(kJ) |
436 |
247 |
151 |
x |
463 |
431 |
299 |
请回答下列问题:
(1)如图表示某反应的能量变化关系图,此反应为______(填“放热”或“吸热”)反应,其中ΔH=______kJ·mol-1(用含C和D的字母表示)。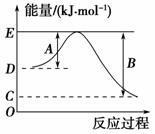
(2)若此能量变化关系图表示反应H2(g)+1/2O2(g)===H2O(g)
ΔH=-241.8 kJ·mol-1,则B=_______kJ·mol-1,x=_____。
(3)表示Cl2与HI气体反应生成碘蒸气与氯化氢的____________。
氯碱厂电解饱和食盐水制取NaOH溶液的工艺流程如下图所示,完成下列填空:
(1)在电解过程中,与电源负极相连的电极上的电极反应式为_____,若检验与电源正极相连的电极上的气体产物,实验室中通常选用的化学试剂是__________。
(2)工业食盐中含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为___________。
(3)如果粗盐中SO42—含量较高,必须添加钡试剂除去,该钡试剂可以是________(选填a、b、c)。
a.Ba(OH)2b.Ba(NO3)2c.BaCl2
(4)为了有效地除去Ca2+、Mg2+、SO42—,加入试剂的合理顺序为_______(选填a、b、c)。
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过________、冷却、________(填写操作名称)除去NaCl。
(11分 )NaCl是价廉且应用广泛的化工业原料,例如,纯碱工业、氯碱工业、氯酸钾工业、肥皂工业等。
(1)19世纪60年代氨碱法是纯碱工业广泛使用的方法,20世纪20年代以后被联合制碱法逐渐取代。
①请写出以NaCl为原料利用氨碱法生产纯碱的化学方程式;
②在联合制碱法中,纯碱工厂与工厂进行联合生产,以方便的获得原料;
③在联合制碱法中循环使用,而在氨碱法中循环使用率不高的物质是。
(2)氯酸钾是重要的化工业产品,在火柴、炸药、雷管、焰火等制造中有重要应用,工业中首先通过电解热食盐水制得氯酸钠,再加入一定量的氯化钾即可得到氯酸钾沉淀。
①在火柴、炸药、雷管、焰火的制造过程中大量使用氯酸钾,主要应用氯酸钾的性;
②请写出电解食盐水生产氯酸钠的化学方程式,该工艺过程中使用的装置与氯碱工业中使用的装置主要区别有(请答出两点);
(3)在肥皂的工业生成过程中,也要使用NaCl的目的是。
央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊进入患者腹中。明胶是水溶性蛋白质混合物,溶于水形成胶体。由工业明胶制成的胶囊往往含有超标的重金属Cr,从而对人体造成伤害。
(1)已知Fe(CrO2)2中铬元素是+3价,则其中铁元素是价。CrO2-是一种酸根离子,则Fe(CrO2)2属于____(填“酸”、“碱”、“盐”或“氧化物”)。明胶的水溶液和K2SO4溶液共同具备的性质是。
a.都不稳定,密封放置沉淀
b.两者均有丁达尔现象
c.分散质粒子可通过滤纸
(2)已知CN-离子、SCN-离子和Cl-离子有相似之处,氰分子(CN)2和硫氰分子(SCN)2的性质与Cl2也有相似之处,且常温常压均为气体,完成下列反应方程式:
①MnO2和HSCN的浓溶液共热的化学方式:。
②(CN)2和NaOH溶液反应的离子方程式:。
(3)已知H2O2是二元弱酸、请写出H2O2与Ca(OH)2溶液反应生成酸式盐的化学式。
汽车发生强烈碰撞时,安全气囊内的NaH发生化学反应生成金属钠与氢气,所产生的气体快速充满气囊,可以达到保护车内人员的目的。
(1)请写出上述反应方程式:它的基本反应类型是
(2)若安全气囊内含有96g NaH,其物质的量为.
(3)若96g NaH完全分解,在标况下,气囊膨胀的体积约为
某溶液中只含有Na2SO4、Na2CO3和NaCl三种溶质。欲证明其中SO42-、CO32-、Cl- 三种阴离子确实存在,我们设计了如下实验,请你认真填写下面的实验报告。
| 实验步骤 |
实验现象 |
结论 |
| 1、向盛放溶液的试管中加入足量。 |
有气泡产生 |
证明有。 |
| 2、继续向试管中加入足量溶液 |
有白色沉淀生成 |
证明有。 |
| 3、过滤,向滤液中加适量的溶液 |
有白色沉淀生成 |
证明有。 |