实验室以含有Mg2+、Cl—、Br—、SO42—等离子的卤水为主要原料制备Mg和Br2,流程如下: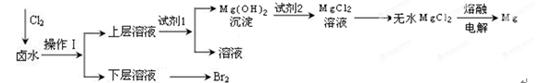
(1)操作Ⅰ使用的试剂是 ;所用主要仪器的名称是 。
(2)为了使Mg2+转化为沉淀,试剂1可以选用 ;加入试剂1后,能够分离得到Mg(OH)2沉淀的方法是 。
(3)试剂2可以选用 。
(4)请写出由无水MgCl2生成Mg的化学反应方程式 。
某学生利用以下装置探究氯气与氨气之间的反应。其中C为纯净干燥的氯气与氨气反应的装置。
请回答下列问题:
(1)装置A中的烧瓶内固体不能选用
| A.生石灰 | B.碱石灰 | C.五氧化二磷 | D.烧碱 |
(2)装置A中发生反应的化学方程式为
(3)B装置的作用;E装置的作用
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。写出反应的化学方程式:
(5)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,需要处理,
写出离子方程式
实验室制备氨气,下列方法中适宜选用的是。
①固态氯化铵加热分解②浓氨水中加入固体氢氧化钠
③加热浓氨水④固态氯化铵与氢氧化钙混合加热
请仔细阅读以下转化关系:
已知:(Ⅰ) 烃类化合物A的质谱图表明其相对分子质量为84;红外光谱表明其分子中含有碳碳双键;核磁共振氢谱显示其分子中只有一种氢原子。
(Ⅱ) D1、D2互为同分异构体,E1、E2互为同分异构体。
(Ⅲ)共轭二烯烃1,2加成:CH2=CH-CH=CH2 +Br2 CH2Br-CHBr-CH=CH2
CH2Br-CHBr-CH=CH2
共轭二烯烃1,4加成:CH2=CH-CH=CH2 +Br2 CH2Br-CH=CH-CH2Br
CH2Br-CH=CH-CH2Br
请回答:
(1)A的结构简式为______________________。
A分子中的碳原子是否都处于同一平面?___________(填“是”或“不是”)。
(2)写出反应②的化学方程式: __________________________________________。
(3)写出下列反应的反应类型:反应①__________、反应②________、反应⑥__________。
(4)写出E1的结构简式并用系统命名法给C命名:
E1____________________________,C的名称:_____________________________。
(5)化合物F是A的同系物,相对分子质量为56,写出F所有可能的结构:
______________________________________________________________________。 (6)写出在加热和浓硫酸作用下,E2与足量反应的化学方程式:
(6)写出在加热和浓硫酸作用下,E2与足量反应的化学方程式:
_______________________________________________________________________。
实验室需要制备纯净的氯化钾。现有含少量KBr和K2SO4的氯化钾样品,按照下图所示的实验方案进行提纯。
请回答下列问题:
(1)操作I的名称为,操作II所需要的玻璃仪器有。
(2)若用硝酸钡来代替氯化钡,是否可行?请说明理由。
。
(3)若实验所得固体甲、乙的质量分别为W 1g和W 2g,则样品中KBr的质量分数计算式为。
(4)某同学对该实验方案提出质疑,他认为加适量氯化钡溶液不容易控制,应该加入过量氯化钡溶液,请你按照他的思路,用上述实验流程图表示出他后面的实验过程,要注明所用试剂和所得产物的化学式以及相应操作的名称。
为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
(1)定性分析:如图甲可通过观察,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是。写出H2O2在二氧化锰作用下发生反应的化学方程式。
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为,检查该装置气密性的方法是
,实验中需要测量的数据是。
某同学为了验证海带中含有碘,拟进行如下实验,请回答相关问题
⑴第1步:灼烧。操作是将足量海带放到灼烧成灰烬。A.试管 B.瓷坩埚
⑵第2步:Iˉ溶液的获取。操作是将灰烬转到烧杯中,加适量蒸馏水,用充分搅拌,煮沸,。(填操作名称)
⑶第3步:氧化。操作是依次加入合适的试剂。下列氧化剂最好选用。(填代号)A.新制氯水 B.H2O2 C.KMnO4溶液理由是。
⑷第4步:碘单质的检验。操作是取少量第3步的溶液,滴加淀粉溶液,如果溶液显蓝色,则证明海带中含碘。