有一透明溶液,可能含有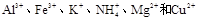 等离子中的一种或几种。现加入Na2O2粉末只有无色无味的气体放出,并同时析出白色沉淀。如加入Na2O2的量与生成白色沉淀的量之间的关系用下图来表示。
等离子中的一种或几种。现加入Na2O2粉末只有无色无味的气体放出,并同时析出白色沉淀。如加入Na2O2的量与生成白色沉淀的量之间的关系用下图来表示。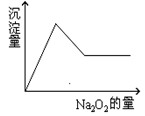
试推断:原溶液中一定含有 ;一定没有 ,可能含 ,为了进一步确定可能含有的离子,应增加的实验操作为 ,现象为 。
某有机物A(只含C、H、O)是一种重要化工生产的中间体,其蒸气密度是相同状况下氢气密度的83倍。试根据下列信息回答相关问题:
①A分子中碳原子总数是氧原子总数的3倍,其苯环上只有一个取代基,且取代基碳链上无支链;
②A可与NaHCO3溶液作用,产生无色气泡:
③A在一定条件下可与乙酸发生酯化反应。
请写出:
(1)A的分子式;
A的一种可能的结构简式;
A中含氧官能团的名称。
若有机物A存在如下转化关系(见下框图),请据此时A的结构回答(2)、(3)、(4)问:
(2)请写出:A→C和B→D的化学反应方程式(注明反应条件),并注明反应类型:
A→C:,
反应类型:。
B→D:,
反应类型:。
(3)A的一种同分异构体F,其苯环上有两个相邻的取代基,且能与三氯化铁溶液发生显色反应。F在稀硫酸存在下水解生成G和H,其中H俗称“木精”,是饮用假酒过程中致人失明、甚至死亡的元凶。
请写出F的结构简式:。
(4)已知H在一定条件下可被氧化成K,K的水溶液常用作防腐剂,请写出:
H→K的化学方程式:。
某学生为了验证苯酚、醋酸、碳酸的酸性强弱,设计了如下实验装置: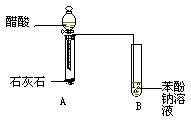
请回答下列问题
(1)仪器B中的实验现象。
(2)仪器B中的化学方程式是。
(3)该实验设计不严密,请改正。
化合物A的学名为邻羟基苯甲酸,其结构简式为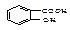 ,俗名水杨酸。
,俗名水杨酸。
⑴A跟下列哪种物质的溶液反应可得一种钠盐,其化学式为C7H5O3Na。
| A. NaOH | B.Na2SO4 | C.NaHCO3 | D.Na |
⑵水杨酸的同分异构体中,属于酚类,同时还属于酯类的化合物有种,其
结构简式分别为、、。
(7分)在密闭容器中,有一定起始浓度的氙(Xe)和F2反应,可得到3种氟化物。各种生成物在平衡体系内的分压与反应温度的关系如右图所示(已知气体的分压之比等于物质的量之比)。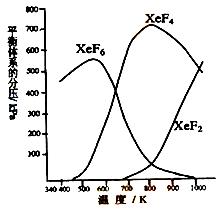
(1)420K时,发生反应的化学方程式为:________________________________________,若反应中消耗1 mol Xe,则转移电子______mol。
(2)600~800K时,会发生反应:XeF6(g) 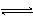 XeF4(g) + F2(g) ,其反应热△H________0(填“>”、“=”或“<”),理由是__________________________________________。
XeF4(g) + F2(g) ,其反应热△H________0(填“>”、“=”或“<”),理由是__________________________________________。
(3)900K时,容器中存在的组分有 。
25时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因 (用离子方程式表示);
(2)混合溶液中由水电离出的c(OH-)____0.1 mol·L-1 NaOH溶液中由水电离出的c(OH-);(填>、<、=)
(3)求出混合液中下列算式的精确计算结果(填具体数字):
c (Na+)-c (A-)= mol·L-1;
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,
①试推断(NH4)2CO3溶液的pH 7 (填>、<、=);
②将相同温度下相同浓度的四种盐溶液:
| A.NH4HCO3 | B.NH4A | C.(NH4)2SO4 | D.NH4Cl |
按pH由大到小的顺序排列 (填序号)