下列金属冶炼的反应原理,错误的是
A.2NaCl(熔融) 2Na+Cl2↑ 2Na+Cl2↑ |
B.Al2O3+3H2 2Al+3H2O 2Al+3H2O |
C.Fe3O4+4CO 3Fe+4CO2 3Fe+4CO2 |
D.2HgO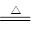 2Hg+O2↑ 2Hg+O2↑ |
将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500ml 2mol/LNaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO2的物质的量为
| A.0.2mol | B.0.6mol | C.0.8mol | D.1.0mol |
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化如图所示,下列说法正确的是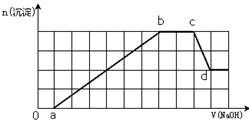
| A.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 |
| B.ab段发生的离子反应为:Al3++3OH—= Al(OH)3↓,Mg2++2OH-= Mg(OH)2↓ |
| C.原溶液中含有的阳离子必定有H+、NH4+、Al3+、Mg2+ |
| D.d点溶液中含有的溶质只有Na2SO4 |
根据表中信息判断,下列选项不正确的是
| 序号 |
反应物 |
产物 |
| ① |
KMnO4、H2O2、H2SO4 |
K2SO4、MnSO4… |
| ② |
Cl2、FeBr2 |
FeCl3、FeBr3 |
| ③ |
MnO4-… |
Cl2、Mn2+… |
A.第①组反应的其余产物为H2O和O2
B.第②组反应中Cl2与FeBr2的物质的量之比可能为1∶2
C.第③组反应中生成1 mol Cl2,转移电子2 mol
D.氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2
标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质的量浓度为c mol/L,则下列选项不正确的是
| A.ρ="(17V+22400" )/ (22.4+22.4V) |
| B.用水稀释该溶液,OH-的物质的量增加 |
| C.该溶液中共有6种微粒 |
| D.c="1000Vρ/(17V+22400)" |
将锌、铁、铜粉末按一定比例混合投入到一定量的硝酸中,微热,充分反应后过滤,弃去滤渣,滤液中金属阳离子情况不可能是
| A.只含Cu2+、Fe2+、Zn2+ | B.只含Zn2+ |
| C.只含Fe2+、Zn2+ | D.只含Cu2+、Fe3+、Zn2+ |