某同学针对石蜡燃烧开展如下延伸探究,请你帮助解决探究过程的相关问题:
【提出问题】石蜡中除含碳、氢元素外,是否还含有氧元素?
【实验设计】根据质量守恒定律,该同学用精制石蜡、棉线烛芯做成蜡烛,设计了如下实验(其中浓硫酸、无水硫酸铜均易吸收水分,药品用量保证充足,部分固定装置省略)。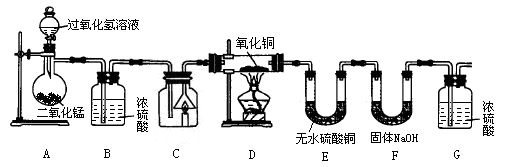
【操作原理】
(1)请写出A装置(含导气管)气密性的检查方法: 。装置A中发生反应的化学方程式是 。
(2)装置B的作用是 ;装置D的作用是 。
(3)装置F发生反应的化学方程式是 。
(4)为达到实验目的,反应前、后必须称量 (填装置序号)装置中的药品质量。
【数据处理】
(5)该同学在老师帮助下,经过一些补充实验和误差处理后得出了如下数据,请你帮助完成数据分析及结论部分。
| 实验事实 |
数据分析及结论 |
| 2.12 g石蜡完全燃烧,得到6.6g CO2和2.88g H2O |
写出计算过程: 结论: 。 |
【讨论交流】误差分析与处理:
(6)根据该学生设计的实验,你认为造成误差的原因是 (填写一条)。
(7)针对你提出的误差原因,提出减少误差的实验或改进措施: 。
蕲春实验中学化学兴趣小组,在学习碱的化学性质时,进行了如图1所示的实验。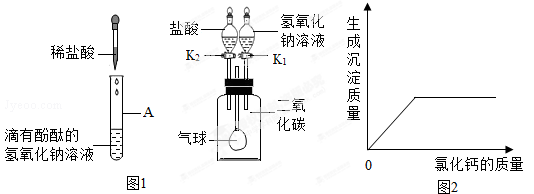
(1)第一组同学在向A中加入一定量的稀盐酸后,发现A中溶液仍然呈红色,则反应后溶液中的溶质是(酚酞除外,用化学式表示) ;第二组同学做完A实验后溶液呈无色,用微观理论解释A中溶液变为无色的反应的实质是 。
(2)第三组同学做B实验用于确认二氧化碳与氢氧化钠能发生化学反应(实验前K1、K2均处于关闭状态)。B实验全过程的操作及现象是:
| 步骤 |
现象 |
| 第一步:; |
气球胀大 |
| 第二步:。 |
气球又缩小至原来状态 |
(3)请写出气球缩小至原来状态的化学方程式 。
(4)实验结束后,小军将以上同学做的A、B两个实验的废液均倒入同一个大烧杯中,观察到混合后的废液呈红色,由此产生疑问:
[提出问题]大烧杯的废液中含有哪些溶质?(酚酞除外)
[查阅资料]氯化钙溶液呈中性,CaCl2+Na2CO3=CaCO3↓+2NaCl
[实验验证]取一定量的废液,逐滴加入氯化钙溶液,如图2为同学们根据部分实验现象绘制的关系曲线。
[实验结论]如果观察到的现象只有沉淀产生,溶液仍然为红色,则废液中的溶质为 ;如果观察到有沉淀产生,溶液仍由红色变为无色,则废液中的溶质为 。
(4分)某化学课堂围绕“酸碱中和反应”,在老师引导下开展探究活动,请你和同学们一起进行实验探究。
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中。
【知识梳理】该反应的化学方程式为(1) ;
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【猜想与假设】
甲组:只有Na2SO4乙组:有Na2SO4和H2SO4丙组:有Na2SO4和NaOH
【收集证据】丙组同学取烧杯中的溶液少量于试管中,滴加几滴酚酞试液溶液,无明显变化,溶液中一定没有(2)。
【表达与交流】为了验证其余猜想,甲组同学的实验方案是取少量试液于试管中,滴加氯化钡溶液,观察是否有白色沉淀产生。你认为他们的实验方案(3)(填“正确”或“不正确”),你的理由是(4)。
乙组同学取少量试液于试管中,加入(5)______溶液,振荡,观察到(6)___________________________,证明自己的猜想是正确的。
【反思与评价】为回收硫酸钠,应取剩余试液于烧杯中,加入(7)______ 溶液,充分搅拌,蒸发即可得到纯净的硫酸钠。
(4分)某同学用如图所示的装置探究二氧化碳气体与氢氧化钠的反应(装置气密性良好)。请回答下列问题: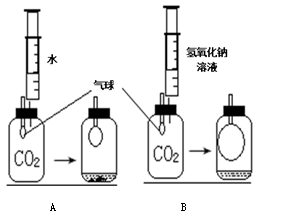
(1)向B中反应后的液体中滴加氢氧化钙溶液,能观察到的现象是;
(2)B中气球体积变大的原因是;
(3)通过对比A、B中气球体积变化不同,可以说明的结论是。
化学小组同学在实验室发现了三瓶无标签待区分的白色固体,标为A、B、C分别是碳酸钠、硫酸钠、碳酸钙中的一种。(提示:可溶性的钡盐有毒)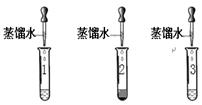
【提出问题】如何区分出三种物质?
【进行实验】甲、乙两位同学进行了如下实验:
步骤一:甲、乙的实验设计与操作相同,分别取A、B、C 瓶中的样品少量于试管中,试管编号对应记为1、2、3号,加等量的水,观察到2号中产生白色浑浊,1、3号中得到无色溶液。
步骤二:甲、乙的实验操作如下图所示: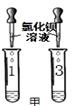
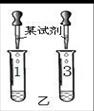

【表达与交流】乙认为甲的实验无法区分1、3号溶液,理由是(1)
。
【证据与结论】经过思考,甲在步骤二的基础上,继续向1、3号管中加入足量稀盐酸,1号中产生的明显现象是(2),产生此现象的化学方程式为(3)。乙同学在区分1、3号中的溶液时选择的与甲不同类别的某试剂是(4)。两位同学通过实验都区分出了三种固体。请将三种固体物质的化学式分别标在广口瓶的标签上(5)。
【反思与评价】对比甲、乙的实验,请你从安全性、简约性的角度对甲或乙同学的实验进行评价 (6)。
某化学兴趣活动小组的同学学习“灭火器原理”后,设计了如下图所示实验,并对反应后锥形瓶中残留废液进行探究(不考虑发泡剂等类物质)。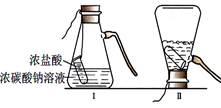
【提出问题】废液中所含溶质是什么物质?
【猜想与假设】
猜想1:废液中的溶质可能是NaCl、Na2CO3和HCl;
猜想2:废液中的溶质只有NaCl;
猜想3:废液中的溶质是NaCl和HCl;
猜想4:废液中的溶质是__________________。
【讨论与交流】小明认为猜想1无需验证就知道是错误的。他的理由是 。
【实验与结论】
(1)为验证猜想2,甲同学取少量废液装入试管中,然后滴入AgNO3溶液,产生白色沉淀,滴加稀硝酸沉淀不溶解。于是甲认为猜想2正确。甲同学的实验________(填“能”或“不能”)验证猜想2的正确性,原因是________________________________。
(2)乙同学为验证猜想3,选锌粒做试剂。假设猜想3是正确的,验证时反应的化学方程式。
(3)若猜想4正确,且最终欲得到纯净的氯化钠溶液需加入_____溶液。
【拓展与应用】
若废液中的溶质是NaCl和HCl,根据HCl的性质,无需另加试剂,只要对废液进行_________操作即可从废液中得到NaCl固体。此方法的缺点是_________________。