已知25℃时,电离常数Ka(HF)=3.6×10-4 mol·L-1,溶度积常数KSP(CaF2)=1.46×10-10 mol3·L-3。现向1L 0.2 mol·L-1HF溶液中加入1L 0.2 mol·L-1CaCl2溶液,则下列说法中,正确的是( )
| A.25℃时,0.1 mol·L-1HF溶液中pH=1 | B.该体系中有CaF2沉淀产生 |
C.该体系中KSP(CaF2)=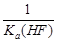 |
D.KSP(CaF2)随温度和浓度的变化而变化 |
海洋是非常巨大的资源宝库,以下有关海洋资源开发利用的说法,不正确的有( )
| A.海洋约占地球表面积的71%,水储量达1.3×109亿吨,故人类不存在缺水问题 |
| B.海水资源的利用包括水资源的利用和化学资源的利用,两者可以综合进行 |
| C.海水中除H2O外,还含有Cl、Na、K、Mg、Ca、S、F等多种元素的化学资源 |
| D.由于与岩石、大气和生物相互作用,海水中溶解和悬浮有大量无机物和有机物 |
我国的能源消耗以煤为主。据估计,全世界的煤炭最多供应200~300年。下列是关于利用煤炭资源的某些观点,其中论述正确的是( )
①直接燃煤虽然带来了污染问题,但同时提供了能量,污染与经济效益相比,经济效益更重要②人类在开发资源时,既要满足自身需要又不能以危害子孙后代为代价是杞人忧天④发展洁煤技术,提高燃煤效率,进行煤的干馏,可以提高煤的实用价值
| A.①④ | B.②③ | C.①② | D.②④ |
《中华人民共和国食品安全法》于2009年6月1日起实施。下列做法不利于食品安全的是( )
| A.用聚氯乙烯塑料袋包装食品 |
| B.在食品盐中添加适量的碘酸钾 |
| C.在食品加工中科学使用食品添加剂 |
| D.研发高效低毒的农药,降低蔬菜的农药残留量 |
根据下表中烃的分子式排列规律,判断空格中烃的同分异构体数目是()
| A.3 | B.4 | C.5 | D.6 |
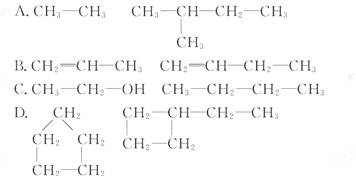
.下列各组物质不属于同系物的是()